Asam dan basa yaitu dua senyawa kimia yang memiliki peran sangat penting didalam kehidupan kita sehari-hari.
Umumnya, berbagai zat yang mempunyai rasa masam tersebut didalamnya mengandung asam.
Contohnya asam asetat pada cuka makanan, asam sitrat pada jeruk, dan asam benzoat yang dipakai sebagai pengawet makanan.
Pengertian Asam Basa

1. Asam
Asam adalah senyawa kimia yang apabila dilarutkan didalam air, maka akan menghasilkan larutan dengan pH lebih kecil dari 7.
Atau,
Asam adalah sebuah zat yang bisa memberi proton (ion H+) terhadap zat lain (basa), atau bisa menerima pasangan elektron bebas dari sebuah basa.
Jadi, bisa diketahui kalo asam menjadi zat (senyawa) yang menimbulkan rasa masam dalm beragam materi.
Contoh masam yaitu seperti jaruk nipis, tomat, dan lemon.
Ciri-ciri masam:
- Dapat menyebabkan korosif.
- Mengubah kertas lakmus biru menjadi merah.
- Dapat menghasilkan ion H+.
- Rasanya asam.
- pH < 7.
Jenis larutan masam:
- Asam kuat.
- Asam astrat.
2. Basa
Basa adalah senyawa kimia yang bisa menyerap ion hidronium saat dilarutkan didalam air dan memiliki pH lebih besar dari 7.
Atau,
Basa menjadi zat (senyawa) yang bisa bereaksi dengan asam, menghasilkan senyawa yang disebut sebagai garam.
Contoh basa yaitu seperti sabun mandi, sampo, sabun cuci, pupuk, pasta gigi, obat maag.
Ciri-ciri basa:
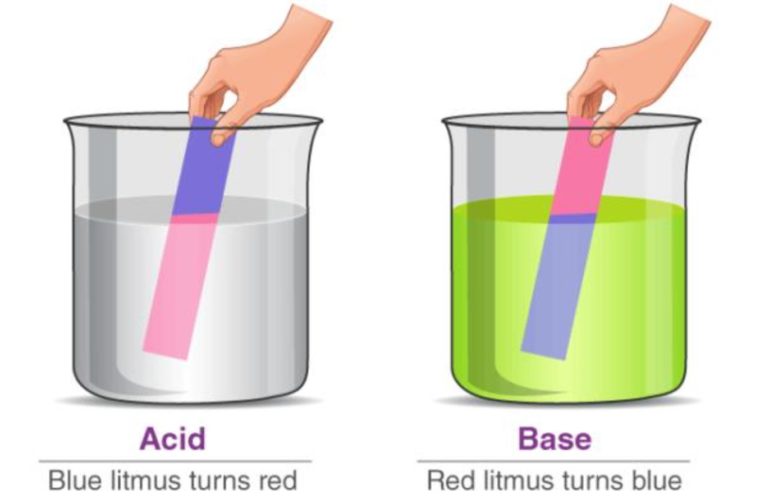
- Mengubah kertas lakmus merah menjadi biru.
- Mempunyai rasa pahit.
- Menghasilkan H- didalam air.
- Terasa licin di kulit.
Jenis larutan basa:
- Basa kuat.
- Basa lemah.
Umumnya, zat-zat asam atau basa bersifat korosif dan beracun. Terutama dalam bentuk larutan dengan kadar yang tinggi. Jadi, sangat berbahaya kalo diuji sifatnya dengan metode merasakannya.
3. Garam
Garam atau Natrium Klorida (Nacl) yaitu senyawa ionik yang terdiri atas ion positif (kation) dan ion negatif (anion), jadi menciptakan senyawa netral (tidak bermuatan).
Reaksi asam dan basa akan menghasilkan garam dengan beragam jenis. Contohnya yaitu seperti garam dapur.
Rumusnya : Asam + Basa ~ Garam + Air.
Teori Asam Basa
Dibawah ini, ada beberapa teori definisi dari asam basa yang perlu diketahui, diantaranya yaitu:
1. Teori Asam Basa Brønsted-Lowry

Pada tahun 1923, Johannes N. Brønsted dengan Thomas M. Lowry secara terpisah udah mengajukan definisi asam dan basa dengan lebih luas.
Konsep yang udah diajukan itu dilihat dari fakta, kalo reaksi asam basa mencangkup transfer proton (ion H+) dari satu zat menuju zat lain.
Proses transfer proton itu, selalu melibatkan asam sebagai pemberi atau donor proton dan basa sebagai penerima atau akseptor proton.
Jadi, didalam pengertian asam basa menurut Brønsted-Lowry seperti:
- Asam adalah donor proton.
- Basa adalah akseptor proton.
Kalo ditinjau pada teori ini, didalam reaksi ionisasi HCI saat dilarutkan dalam air, HCI akan berperan sebagai asam dan H2O sebagai basa.
HCl(aq) + H2O(l) → Cl–(aq) + H3O+(aq)
HCl akan berubah kedalam ion Cl– selepas berhasil memberikan proton (H+) terhadap H2O. H2O.
Lalu, menerima proton dengan memakai sepasang elektron bebas terhadap atom O guna berhubungan dengan H+, jadi akan tercipta ion hidronium (H3O+).
Sedangkan, terhadap reaksi ionisasi NH3 saat dilarutkan dalam air, NH3 berperan sebagai basa dan H2O sebagai asam.
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH–(aq)
NH3 akan menerima proton (H+) dari H2O dengan memakai sepasang elektron bebas terhadap atom N guna berikatan dengan H+.
Jadi, akan terbentuk ion ammonium (NH4+). H2O akan berubah menjadi ion OH− selepas memberikan proton (H+) terhadap NH3.
Dari kedua contoh diatas, maka nampak kalo:
- Asam harus memiliki atom hidrogen yang bisa terlepas sebagai ion H+.
- Basa harus memiliki pasangan elektron bebas yang bisa berhubungan dengan ion H+.
Kelebihan definisi dari Brønsted-Lowry yaitu:
- Bisa menerangkan reaksi-reaksi asam basa didalam fase padat, gas, cair.
- Larutan dengan pelarut selain air atau campuran heterogen.
Contohnya:
Reaksi antara gas NH3 (basa) dan gas HCl (asam) membentuk asap NH4Cl.
NH3(g) + HCl(g) → NH4Cl(s)
Beberapa zat bisa bertindak sebagai asam, tapi juga bisa sebagai basa didalam reaksi yang lain.
Contoh: H2O, HCO3–, dan H2PO4–. Zat seperti itu disebut sebagai amfiprotik.
Sebuah zat amfiprotik (contoh H2O) akan bertindak sebagai asam kalo direaksikan dengan zat yang lebih basa darinya (contoh NH3) dan bertindak sebagai basa kalo direaksikan dengan zat yang lebih asam darinya (contoh HCl).
2. Teori Asam Basa Arrhenius

Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini.
Definisi asam basa menurut Arrhenius seperti ini:
- Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H+.
- Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH–.
Gas asam klorida (HCI) yang sangat larut didalam air tergolong kedalam asam Arrhenius.
Sebagaimana, dengan HCI yang bisa terurai menjadi ion H+ dan Cl– didalam air.
Selain itu, natrium hidroksida (NaOH) juga termasuk kedalam basa Arrhenius.
Sebagaimana, NaOH yaitu senyawa ionik yang terdisosiasi menjadi ion Na+ dan OH– pada saat dilarutkan didalam air.
Konsep asam basa dari Arrhenius saat ini, terbatas dengan keadaan air sebagai pelarut.
3. Teori Asam Basa Lewis

Tahun 1923, Gilbert Newton Lewis mengemukakan sebuah teori asam basa yang lebih luas daripada kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berhubungan dengan struktur dan ikatan.
Definisi asam basa menurut G. N. Lewis seperti ini:
- Asam merupakan akseptor pasangan elekrton.
- Basa merupakan donor pasangan elektron.
Dilihat dari definisinya, asam yang memiliki peran sebagai spesi penerima pasangan elektron tidak cuma H+.
Senyawa yang mempunyai orbital kosong di kulit valensi seperti BF3 juga bisa berperan menjadi asam.
Contohnya:
Reaksi antara BF3 dan NH3 yaitu reaksi asam basa, dimana BF3 sebagai asam Lewis dan NH3 sebagai basa Lewis.
NH3 akan memberikan pasangan elektron terhadap BF3, jadi akan menciptakan ikatan kovalen koordinasi antara keduanya.

Kelebihan definisi asam basa menurut Lewis yaitu bisa menerangkan reaksi-reaksi asam basa lain didalam fase gas, padat, dan medium pelarut selain air yang tidak melibatkan transfer proton.
Contohnya:
- Reaksi-reaksi yang terjadi antara oksida asam (contoh CO2 serta SO2) dengan oksida basa (contohnya MgO serta CaO).
- Reaksi-reaksi pembentukan ion kompleks seperti [Fe(CN)6]3−, [Al(H2O)6]3+, dan [Cu(NH3)4]2+
- Sebagian reaksi didalam kimia organik.
Sifat Asam Basa

Berikut dibawah ini, ada beberapa sifat-sifat dari asam basa yang perlu kamu tahu, diantaranya yaitu:
1. Sifat Asam
Ada beberapa sifat-sifat utama dari asam, diantaranya sebagai berikut ini:
-
Rasa Asam yang Khas
Sifat yang paling mencirikan sebagai asam merupakan adanya rasa asam apabila dirasakan indra pengecap.
Contohnya: Cuka.
Didalam ilmu kimia, cuka dikenal sebagai asam asetat (asam etanoat).
-
Bisa Mengubah Warna Indikator
Sifat asam bisa diidentifikasi dengan memakai indikator. Indikator yang paling sering dimanfaatkan yaitu kertas lakmus.
Kalo sebuah senyawa memiliki sifat asam, maka kertas lakmus biru akan berubah menjadi merah. Sedangkan, kertas lakmus merah akan tetap berwarna merah.
-
Bereaksi dengan Logam Tertentu Guna Menghasilkan Gas H2
Senyawa asam yang bereaksi dengan beberapa jenis logam akan menghasilkan gas hidrogen.
Contohnya: Logam magnesium, tembaga, besi, dan seng.
Tapi, hasil reaksi keduanya bukan berupa gas hidrogen aja, tapi juga mengandung senyawa garam.
Contoh reaksinya:
Asam + Logam tertentu + Garam + Gas Hidrogen
Apabila kamu mereaksikan antara dua senyawa asam yang berbeda dengan logam yang sama.
Maka, kamu akan mendapatkan hasil yang berbeda, begitu juga sebaliknya. Kalo kamu mereaksikan dua logam dengan senyawa asam yang sama.
Hal tersebut dikarenakan, ada perbedaan kekuatan asam yang digunakan.
-
Bereaksi dengan Basa Guna Membentuk Garam dan Air
-
Bisa Menghantarkan Arus Listrik
Hal tersebut disebabkan asam bisa melepaskan ion-ion didalam larutannya. Asam kuat yaitu elektrolit yang baik.
Semakin kuat sebuah asam, maka akan semakin baik juga daya hantar listriknya (mempunyai sifat elektrolit yang baik).
Contoh: Asam sulfat yang ada didalam aki mobil.
Larutan asam memiliki pH kurang dari 7, dengan nilai pH yang lebih rendah sesuai dengan peningkatan keasaman.
-
Oksida Asam
Oksida asam merupakan oksida yang asalnya dari unsur nonlogam dengan oksigen.
Contohya:
CO2, SO2, P2O5, Cl2O7 dan yang lainnya. Oksida asam apabila bereaksi dengan air, maka akan menghasilkan larutan asam.
Oksida merupakan senyawa antara unsur tertentu dengan oksigen.
2. Sifat Basa
Ada beberapa sifat-sifat utama dari basa, diantaranya sebagai berikut ini:
-
Memiliki Rasa Pahit
Senyawa basa kal dirasakan dengan menggunakan indra pengecap, rasanya terasa pahit.
Contohnya: Pada saat secara tidak sengaja memakan sabun.
-
Basa Terasa Licin
Contohnya: Saat kamu memegang sabun, maka sabun tersebut akan teras licin.
-
Bersifat Korosif
Beberapa senyawa basa merupakan jenis senyawa basa yang kuat.
Basa kuat tersebut memiliki sifat korosif, jadi kalo disentuh bisa menyebabkan iritasi ataupun terbakar.
-
Menghantarkan Arus Listrik
Senyawa basa juga bisa menghantarkan listrik yang baik, terutama untuk basa yang kuat.
Basa kuat mudah terionisasi didalam air, sehingga bisa menghantarkan arus listrik.
-
Menetralkan Sifat Asam
Senyawa basa bisa digunakan buat menetralkan asam. Senyawa asam akan berkurang sifat keasamannya, bahkan bisa berubah jadi tidak asam kalo direaksikan dengan basa.
Asam dan basa yang direaksikan bisa menghasilkan garam dan air. Reaksi itu, disebut sebagai reaksi penetralan (netralisasi).
Contohnya:
Kalsium hidroksida + asam sulfat → garam kalsium sulfat + air
-
Kalo Dilarutkan Kedalam Air Menghasilkan Ion Hidroksida OH–
-
Oksida Basa
Oksida basa merupakan oksida yang asalnya dari unsur logam dengan oksigen.
Contohnya: Na2O, CaO, Fe2O3, dan lainnya. Oksida basa apabila bereaksi dengan air akan menghasilkan larutan basa.
Diantara senyawa oksida, ada yang disebut sebagai oksida indiferen, yaitu oksida yang tidak bisa membentuk asam atau basa. Contohnya: CO dan NO.
Tidak cuma itu, ada juga oksida amfoter. Amfoter yaitu bisa bereaksi dengan ion asam (H+) dan ion basa (OH–). Contohnya: Al2O3 dan ZnO.
-
Memiliki pH Lebih dari 7
Semakin besar nilai pH sebuah zat, maka akan semakin kuat derajat kebasaanya.
Contohnya:
- Amoniak untuk pelarut desinfektan.
- Soda api (natrium hidroksida) untuk membersihkan saluran bak cuci.
- Aluminium hidroksida dan magnesium hidroksida untuk obat nyeri lambung.
Klasifikasi Asam Basa
Asam basa digolongkan berdasarkan kekuatannya dan terionisasi yang dibagi menjadi dua, yaitu:
1. Asam Kuat dan Basa Kuat
Asam kuat yaitu senyawa yang terurai secara keseluruhan pada waktu dilarutkan didalam air dan akan menghasilkan jumlah ion seluruhnya.
Contohnya: HCL, HNO3, H2SO4, HCIO4
Basa kuat merupakan senyawa yang terurai secara keseluruhan pada waktu dilarutkan kedalam air.
Contohnya: NaOH, KOH, Ba(OH)2
2. Asam Lemah dan Basa Lemah
Asam lemah merupakan senyawa yang sedikit terurai pada waktu dilarutkan didalam air.
Contohnya: H3PO4, H2SO3, HNO2, CH3COOH
Basa lemah merupakan senyawa yang cuma sedikit terurai pada waktu dilarutkan kedalam air.
Contohnya: NaHCO3, NH4OH
Lalu berdasarkan bentuk ionnya, asam basa diklasifikasikan menjadi:
- Asam anion yaitu asam yang memiliki muatan negatif. Contohnya: SO3–
- Asam kation yaitu asam yang memiliki muatan positif. Contohnya: NN4+
- Basa anion yaitu basa yang memiliki muatan negatif. Contohnya: CI–, CN–
- Basa kation yaitu basa yang memiliki muatan positif. Contohnya: Na+, Ca2+
Contoh Soal

1. Tentukan manakah asam dan basa didalam reaksi asam basa berikut dengan cara memberikan alasan berdasarkan teori asam basa Brønsted-Lowry, Arrhenius, atau Lewis.
Ni2+(aq) + 4CN–(aq) ⇌ [Ni(CN)4]2-(aq)
Jawab:
Teori Arrhenius serta teori Brønsted-Lowry tidak bisa menjelaskan reaksi diatas.
Dilihat dari teori Lewis, CN– adalah basa Lewis, sebab mendonorkan pasangan elektron terhadap ion Ni2+ jadi akan terbentuk ikatan kovalen koordinasi, sedangkan Ni2+ adalah asam Lewis, karena menerima pasangan elektron dari CN–.
Itulah beberapa pembahasan lengkap mengenai Pengertian Asam Basa. Gimana? Sangat mudah dipahami kan?
Semoga pembahasan diatas, bisa membantu dan bermanfaat untuk kalian semua sobat cerdika.com 😀

