Ikatan kimia yaitu ikatan yang bisa terjadi karena adanya berbagai unsur didalam kondisi yang tidak stabil.
Tapi, berusaha menjadi stabil seperti gas mulia dengan cara membentuk ikatan dengan unsur yang lain.
Kalo dilihat dari jenisnya ikatan kimia dibagi menjadi 2, yaitu ikatan kovalen dan ikatan ion.
Sekarang kita akan membahas salah satu jenis ikatan kimia, yaitu ikatan ion.
Apa itu ikatan ion? Ingin tahu? Yuk, simak ulasannya dibawah ini!
Pengertian Ikatan Ion
Ikatan ionik (ion) yatu ikatan yang bisa terjadi akibat dari adanya perpindahan elektron dari satu atom menuju atom yang lainnya.
Ada beberapa syarat sebuah ikatan ionik bisa terbentuk, diantaranya yaitu:
- Berlangsungnya transfer elektron dari unsur elektropositif menuju unsur elektronegatif.
- Tercipta antara unsur yang elektropositif (logam) dengan unsur yang elektronegatif (nonlogam).
- Unsur elektropositif akan melepaskan elektron yang membentuk kation, sedangkan unsur yang elektronegatif akan menangkap elektron yang membentuk anion.
Tidak cuma itu aja, ikatan ionik juga bisa terjadi akibat adanya serah terima elektron.
Jadi, menciptakan ion positif dan ion negatif yang konfigurasi elektronnya sama dengan gas mulia.
Ion positif dan ion negatif diikat oleh sebuah gaya elektromagnetik. Senyawa yang dihasilkan disebut sebagai senyawa ion.
Ciri-Ciri Ikatan Ion
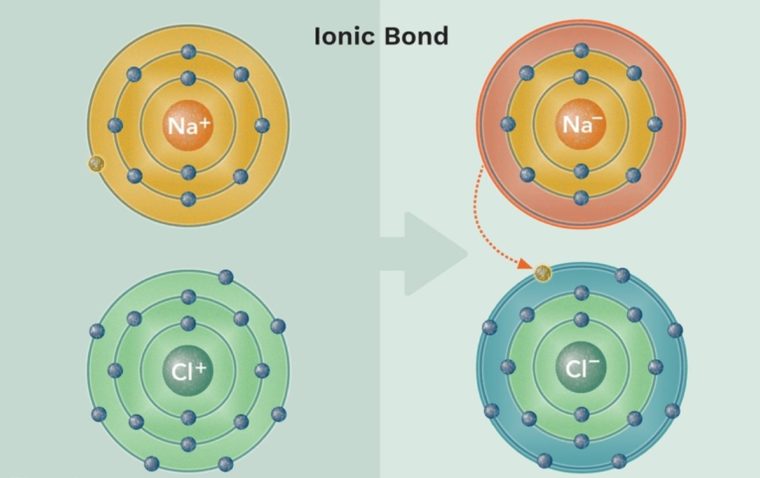
Ada beberapa ciri-ciri dari ikatan ion atau ionik yang perlu diketahui, diantaranya seperti:
- Suatu ikatan ionik terbentuk melalui transfer penuh elektron valensi dari satu atom ke atom lain untuk mencapai suatu kestabilan.
- Jenis ikatan ini memungkinkan terbentuknya dua muatan ion yang berlawanan yaitu ion bermuatan positif atau kation dan ion bermuatan negatif atau anion.
- Keberadaan dua ion dengan muatan yang berlawanan ini akan menghasilkan gaya tarikan yang kuat antara keduanya.
- Ikatan ionik terjadi antara atom non logam dengan atom logam alkali atau alkali tanah.
- Ikatan ionik terbentuk dari atom yang memiliki perbedaan elektronegativitas yang besar bahkan lebih besar daripada ikatan kovalen polar.
- Senyawa yang terbentuk dengan adanya gaya tarik elektrostatik antara ion positif dan ion negatif disebut dengan senyawa ionik.
Sifat Ikatan Ion

Berikut dibawah ini, ada beberapa macam-macam sifat yang ada didalam ikatan ion, diantaranya yaitu:
1. Membentuk Kristal
Keistimewaan sebuah senyawa ionik yaitu senyawa tersebut berada dalam bentuk kristal.
Pada tingkat atomik, suatu anion dan kation akan saling bergabung buat membentuk susunan struktur kristal tiga dimensi berdasarkan ukuran dari ion yang terlibat didalamnya.
Suatu kristal memiliki struktur yang rapi dan berulang.
Contohnya: Dalam garam dapur (NaCl) memiliki struktur kristal kubus dimana ion Na+ dan Cl– akan membentuk susunan kubus secara berulang dan tentunya tiga dimensi.
2. Titik Didih dan Titik Leleh yang Tinggi
Energi yang lebih besar diperlukan buat memecah ikatan ionik yang terjadi antara ion positif dan ion negatif dalam senyawa ionik.
Makanya, titik didih dan titik leleh dari suatu senyawa ionik juga akan lebih tinggi dan umumnya lebih tinggi dari senyawa kovalen.
Titik didih yang tinggi juga membuat senyawa ionik tidak mudah menguap.
Jadi, umumnya senyawa ionik tidak memiliki bau yang menyengat, karena tidak ada zat yang berbentuk gas dan bisa dihirup oleh indra penciuman.
3. Entalpi Peleburan dan Penguapan yang Tinggi
Sesuai dengan sifatnya yang memiliki titik didih dan titik leleh tinggi.
Senyawa ionik juga memiliki kalor entalpi peleburan dan penguapan yang 10-100 kali lebih tinggi dibandingkan suatu senyawa molekular.
Entalpi peleburan merupakan panas yang dibutuhkan buat melelehkan satu mol padatan dalam tekanan konstan.
Sedangkan, entalpi penguapan yaitu panas yang dibutuhkan buat menguapkan satu mol senyawa dalam bentuk cairan pada tekanan tetap.
4. Keras Tapi Rapuh
Kekerasan yang tinggi pada senyawa ionik akibat adanya tarikan yang sangat kuat antara ion positif dan ion negatif dalam senyawa ionik, jadi membuat satu dengan yang lain sulit untuk dipisahkan.
Tapi, adanya tekanan bisa menginduksi gaya elektrostatik didalamnya buat memecahkan kristal tersebut.
Saat suatu struktur udah mengalami split maka sangat mudah buat senyawa ionik tersebut untuk pecah.
Makanya, suatu senyawa ionik memiliki struktur yang keras tapi rapuh.
5. Larut dalam Air
Senyawa ionik merupakan senyawa yang mudah larut dalam air. Air merupakan sebuah senyawa yang bersifat sangat polar.
Dimana, struktur air memiliki muatan dipol positif pada atom hidrogen dan dipol negatif pada oksigen yang disebabkan karena tarikan elektron oleh atom oksigen dimana atom ini memiliki nilai elektronegativitas yang tinggi.
Adanya muatan dipol dalam air maka suatu senyawa ionik akan terdisosiasi dalam air menjadi ion penyusunnya dan masing-masing ion tersebut akan tertarik pada muatan dipol air yang berlawanan.
Hal ini menjelaskan pernyataan diawal mengapa garam bisa larut dalam air dimana ion Na+ akan tertarik ke arah atom oksigen dari air, sedangkan ion Cl– akan tertarik ke arah hidrogen dari molekul air.
6. Larutan dan Lelehan Dapat Menghantarkan Listrik
Dalam air, senyawa ionik akan terdisosiasi sebagai anion dan kation.
Adanya anion dan kation memungkinkannya buat jadi konduktor listrik dimana masing masing ion itu yang akan bergerak dalam larutan buat mengalirkan listrik.
Selain larutannya, lelehan dari senyawa ionik juga bisa menjadi penghantar listrik.
7. Isolator yang Baik
Meskipun dalam bentuk larutan dan lelehannya dapat menghantarkan listrik, tapu padatan senyawa ionik tidak bisa menghantarkan listrik atau bersifat isolator.
Karena, setiap ion terikat begitu erat dengan ion yang lain jadi tidak memungkinkan terjadinya pergerakan elektron buat menghantarkan listrik.
Proses Pembentukan Ikatan Ion
Setiap unsur harus berupaya buat memiliki konfigurasi elektron seperti gas mulia, bisa dengan cara melepaskan elektron atau menerima elektron agar stabil.
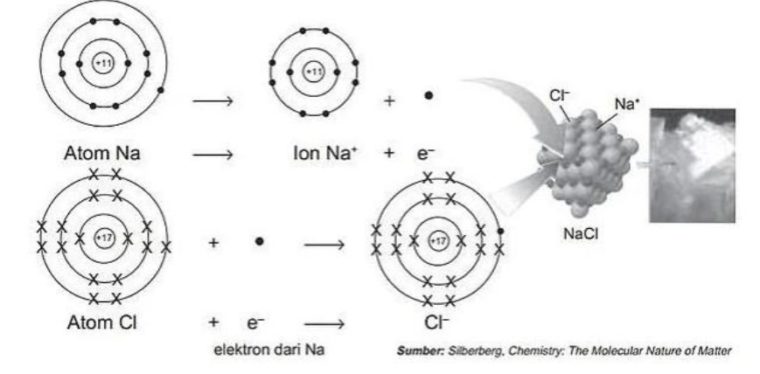
Peristiwa serah terima elektron satu ini, bisa berlangsung terhadap senyawa NaCl alias garam dapur.
Keterangannya:
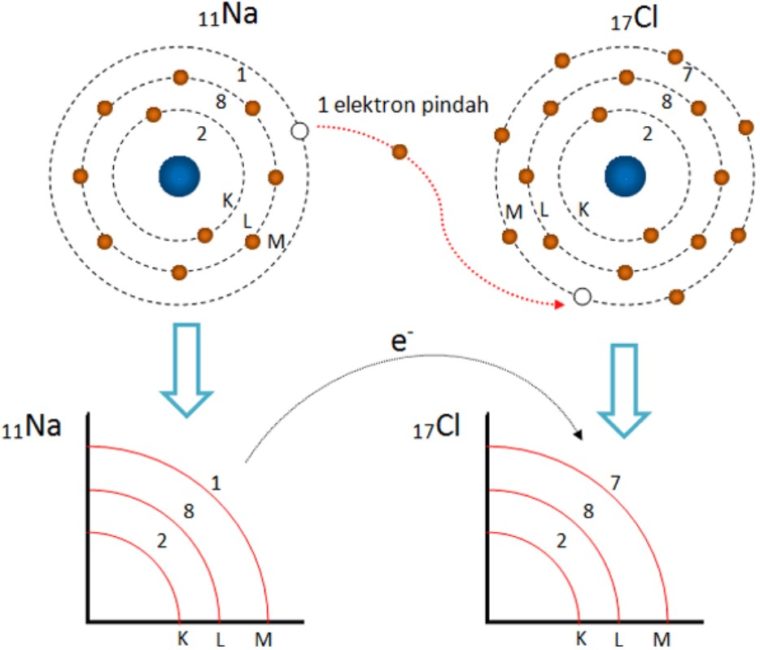
Na adalah golongan IA yang IA mempunyai elektron valensi 1, sehingga agar stabil, IA harus bisa melepas 1 elektron.
Kalo dilihat dari konfigurasi elektronnya, maka 11Na: 2, 8, 1.
Jadi, pada saat terjadinya pelepasan 1 elektron, maka elektron yang paling terakhir akan menjadi 8 (sesuai kaidah oktet).
Karena melepas 1 elektron, maka Na yang asalnya netral akan berubah menjadi bermuatan +1 (Na+).
Reaksinya:
Na → Na+ + e- (yang berarti Na melepas 1 elektron, lihat elektron yang ada di bagian sebelah kiri panah).
Lalu dimana kira-kira 1 elektron yang dilepas oleh Na?
Elektron yang lepas tersebut ditangkap oleh Cl. Sebab Cl memiliki elektron valensi 7 (dia termasuk golongan VIIA).
Maka, kalo dilihat dari konfigurasi elektronnya 17Cl : 2, 8, 7. Jadi, kalo Cl itu menangkap 1 elektron, konfigurasinya akan berubah menjadi 2, 8, 8, dengan elektron terakhir yaitu 8, ini udah mematuhi kaidah oktet.
Karena Cl telah menangkap 1 elektron, maka Cl yang asalnya netral akan berubah wujud menjadi -1 (Cl-).
Reaksinya:
Cl + e- → Cl- (yang berarti Cl menerima 1 elektron, lihat elektron yang ada di sebelah kiri panah).
Pengaruh dari pembentukan Na+ dan Cl- sesuai dengan Hukum Coulomb, muatan yang beda jenisnya akan saling tarik menarik.
Jadi, Na+ ini akan berikatan dengan Cl- dengan adanya gaya elektrostatik.
Na+ + Cl- → NaCl
Supaya lebih jelasnya, simak gambar dibawah ini:
Maka bisa diketahui, unsur pembentuknya seperti ini:
Ikatan ion = Logam + Non Logam
Kalo digeneralisir, ikatan logam tersebut diantaranya yaitu:
- Golongan IA (kecuali H).
- IIA (kecuali Be).
- IIIA (Aluminium).
- Golongan transisi (Golongan B).
Sedangkan untuk non logam, diantaranya seperti:
- Golongan IVA-VIIA.
- Jika VIIIA relatif stabil.
Contohnya:
- K2O memiliki ikatan ionik, karena K termasuk kedalam logam (golongan IA) dan O termasuk golongan non logam (golongan VIA).
- CH4 tidak memiliki ikatan ionik, karena C termasuk kedalam golongan non logam (golongan IVA) dan H termasuk non logam (golongan IA, tapi buat H sifatnya kovalen).
- KF memiliki ikatan ionik, karena K termasuk kedalam golongan logam (golongan IA) dan F termasuk kedalam golongan non logam (golongan VIIA).
Keunikan Ikatan Ion

Berikut dibawah ini, ada beberapa keunikan yang ada pada ikatan ion, diantaranya seperti:
- Senyawa ionik mudah sekali untuk menghantarkan listrik apabila didalam larutan.
- Ikatan ionik tercipta atau terbentuk antara ion logam (ion positif) dengan ion non-logam (ion negatif).
- Ikatan ionik mudah sekali larut di dalam air serta pelarut polar lainnya.
- Senyawa ionik cenderung akan menciptakan kristal solid dengan titik leleh yang sangat tinggi.
- Penamaan ikatan ionik sederhana dimulai dari nama logam, lalu diikuti dengan nama non-logam penyusunnya. Contoh: Natrium klorida.
Ikatan ion terjadi karena adanya gaya tarik-menarik antar ion yang bermuatan positif dengan ion yang bermuatan negatif.
Contoh Ikatan Ion
Salah satu contoh ikatan ion yang paling sering di temukan dalam kehidupan sehari-hari adalah garam dapur.
Didalam garam dapur tersebut, berlaku suatu rumus kimia yakni NaCl (Natrium klorida).
Pada NaCl padat ada ikatan antara ion Na+ dengan ion Cl- dengan gaya elektrostatik, jadi hal tersebut bisa disebut sebagai ikatan ion.
Bentuk kristal NaCl merupakan salah satu rangkaian antara ion Na+ dengan ion Cl-.
Satu ion Na+ ini, dikelilingi dengan enam ion Cl- dan satu ion Cl- dikelilingi dengan enam ion Na+ seperti gambar diatas.
Itulah beberapa pembahasan lengkap mengenai Pengertian Ikatan Ion. Gimana? Sangat mudah dipahami kan?
Semoga pembahasan diatas, bisa membantu dan bermanfaat untuk kalian semua sobat cerdika.com 😀