Sebenarnya, pengertian dari termodinamika itu apa sih? Kalo belum tahu, langsung aja yuk ke pembahasan lengkapnya dibawah ini.
Pengertian Termodinamika

Termodinamika merupakan suatu ilmu yang menggambarkan usaha buat mengubah kalor (perpindahan energi yang disebabkan perbedaan suhu) jadi energi dan sifat-sifat pendukungnya.
Termodinamika ini berhubungan erat dengan Fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika juga berhubungan dengan mekanika statik.
Cabang ilmu Fisika ini mempelajari suatu pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas dan lingkungan.
Aplikasi dan penerapan termodinamika bisa terjadi pada tubuh manusia, peristiwa meniup kopi panas, perkakas elektronik, refrigerator, mobil, pembangkit listrik dan industri, itu adalah peristiwa termodinamika yang dekan dengan kehidupan sehari-hari.
Prinsip Termodinamika
Penerapan prinsip-prinsip termodinamika yang meliputi mekanika, panas dan kalkulus diferensial pada ilmu pengetahuan lain seperti yang ditunjukan pada gambar diatas.
Kemudian, pada gambar dibawah ini menunjukkan kalo penyelesaian suatu masalah/problem secara termodinamika bisa dilakukan melalui beberapa tahapan, yaitu:
Formulasi problem ke dalam besaran & bentuk termodinamika. Hal ini yang dikatakan sebagai mengubah bahasa dalam problem ke dalam bahasa termodinamika, lalu merumuskannya dengan memakai besaran-besaran termodinamika.
Evaluasi sifat dan fungsi termodinamika, berarti melakukan analisis terhadap formulasi yang udah disusun pada langkah pertama (1). Tahap ini membutuhkan pemahaman pengetahuan termodinamika yang memadai agar gak terjadi kesalahan persepsi terhadap arah atau tujuan problema tersebut.
Penyelesaian problem termodinamika. Pada tahap ini dibutuhkan dukungan pengetahuan matematika/kalkulus (deferensial, integral) jadi bisa diperoleh jawaban yang valid atau bisa dipertanggungjawabkan.
Ketiga langkah penyelesaian termodinamika tersebut harus berpijak pada dalil – dalil atau kaidah – kaidah yang ada didalam termodinamika.
Intinya, prinsip termodinamika sebenarnya yaitu hal alami yang terjadi dalam kehidupan sehari – hari.
Dengan berkembangnya ilmu pengetahuan dan teknologi, termodinamika direkayasa sedemikian rupa sehingga menjadi suatu bentuk mekanisme yang bisa membantu manusia dalam kegiatannya.
Pengembangan ilmu termodinamika dimulai dengan pendekatan makroskopik yaitu perilaku umum partikel zat yang jadi media pembawa energi.
Sistem Termodinamika
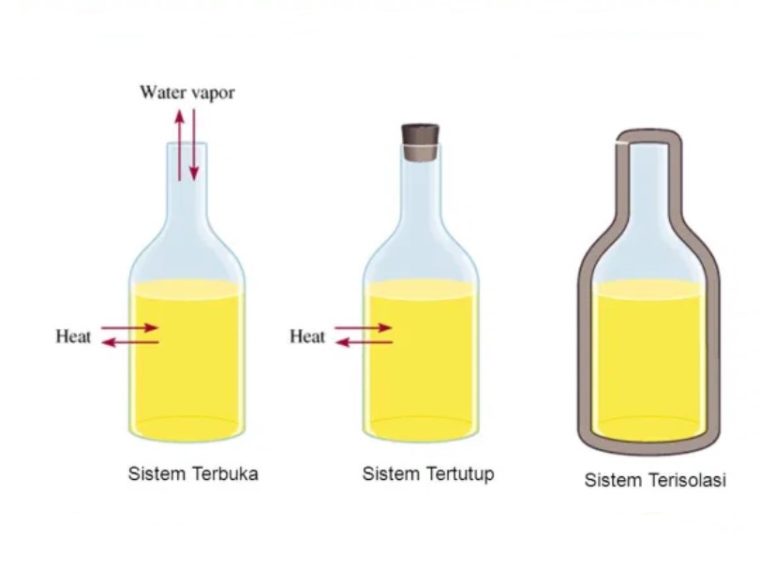
Sistem termodinamika merupakan bagian – bagian dari lingkungan yang diperhitungkan.
Klasifikasi sistem termodinamika ini berdasarkan pada sifat batas sistem lingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Nah, berikut ini ada beberapa jenis dari sistem termodinamika berdasarkan jenis pertukaran antara sistem dan lingkungan, yaitu:
1. Sistem Terbuka
Sistem yang terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel.
Contoh dari sistem terbuka ini adalah Samudra.
Perjanjian yang dipakai buat menganalisa sistem terbuka yaitu:
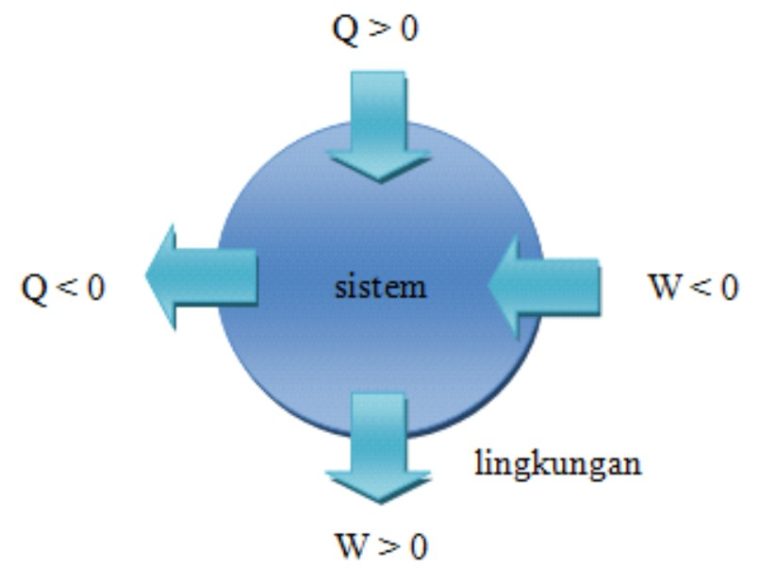
- Buat panas (Q) bernilai positif, kalo diberikan kepada sistem dan bernilai negatif kalo keluar dari sistem.
- Buat usaha (W) bernilai positif kalo keluar dari sistem dan bernilai negatif kalo diberikan (masuk) ke dalam sistem.
2. Sistem Tertutup
Sistem ini terjadi pertukaran energi (panas dan kerja), tapi gak terjadi pertukaran benda dengan lingkungannya.
Contoh sistem tertutup yaitu balon udara yang dipanaskan, dimana massa udara didalam balon tetap. Tapi, volumenya berubah dan energi panas masuk kedalam masa udara didalam balon.
Suatu sistem bisa mengalami pertukaran panas dan kerja atau keduanya, biasanya dipertimbangkan sebagai sifat pembatasnya yaitu:
- Pembatas Adiabatik merupakan gak memperbolehkan adanya pertukaran panas.
- Pembatas Rigid merupakan gak memperbolehkan adanya pertukaran kerja.
3. Sistem Terisolasi
Sistem terisolasi merupakan sistem yang menyebabkan gak terjadinya pertukaran panas, zat atau kerja dengan lingkungannya.
Contohnya: Air yang disimpan dalam termos dan tabung gas yang terisolasi.
Dalam kenyataan, sebuah sistem gak bisa terisolasi sepenuhnya dari lingkungan karena pasti ada terjadi sedikit pencampuran, walaupun cuma penerimaan sedikit penarikan gravitasi.
Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
Karakteristik yang menentukan sifat dari sistem disebut dengan property (koordinat sistem/variabel keadaan sistem), seperti tekanan (p), temperatur (T), volume (v), masa (m), viskositas, konduksi panas dan lainnya.
Selain itu, ada juga koordinat sistem yang didefinisikan dari koordinat sistem yang lainnya seperti, berat jenis, volume spesifik, panas jenis dan lain sebagainya.
Suatu sistem bisa berada pada suatu kondisi yang gak berubah, kalo masing-masing jenis koordinat sistem tersebut bisa diukur pada semua bagiannya dan gak berbeda nilainya.
Hukum Dasar Termodinamika
Nah, jadi ada 4 hukum dasar yang berlaku didalam sistem dari sebuah termodinamika, diantaranya yaitu:
1. Hukum Awal (Zeroth Law) Termodinamika
Hukum awal termodinamika ini menyatakan kalo dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya.
2. Hukum Termodinamika 1
Hukum pertama termodinamika ini juga terkait dengan kasus kekekalan energi.
Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup, sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem.
Hukum ini bisa diuraikan menjadi beberapa proses yaitu proses dengan isokhorik, isotermik, isobarik dan adiabatik.
3. Hukum Termodinamika 2
Hukum termodinamika kedua ini terkait dengan entropi. Gak ada bunyi buat hukum kedua termodinamika, cuma ada pernyataan eksperimental yang dikeluarkan oleh kelvin-plank dan clausius.
Pernyataan Clausius yaitu:
Gak mungkin suatu sistem apapun bekerja sedemikian rupa, jadi hasil satu-satunya yaitu perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi.
Pernyataan Kelvin-Plank yaitu:
Gak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja kesekeliling dengan menerima energi panas dari satu reservoir termal.
4. Hukum Termodinamika 3
Hukum termodinamika ketiga ini terkait dengan temperatur nol absolut.
Hukum ini menyatakan kalo pada saat suatu sistem mencapai temperatur nol absolut, maka semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.
Hukum termodinamika ketiga juga menyatakan kalo entropi benda berstruktur kristal sempurna pada temperatur nol absolut yang bernilai nol (0).
Proses – Proses Termodinamika
Proses termodinamika terbagi menjadi empat macam, tergantung dari keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut.
Ada dua hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yaitu variabel yang berubah dan usaha yang dilakukan.
1. Isokhorik
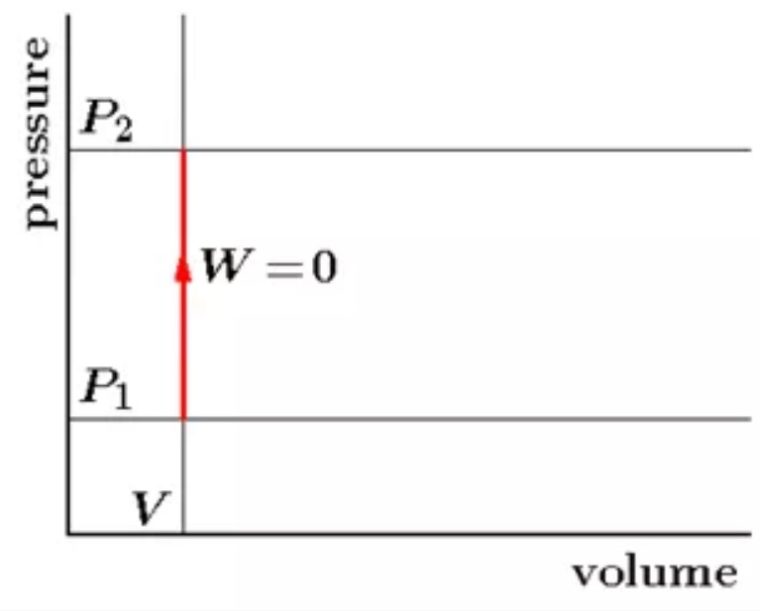
Isokhorik merupakan proses termodinamika yang gak mengubah nilai volume sistem (ΔV = 0)
Pada proses ini, nilai usahanya adalah 0 karena gak ada suatu luasan bangun yang ada pada gambar P-V dibawah ini.
2. Isobarik
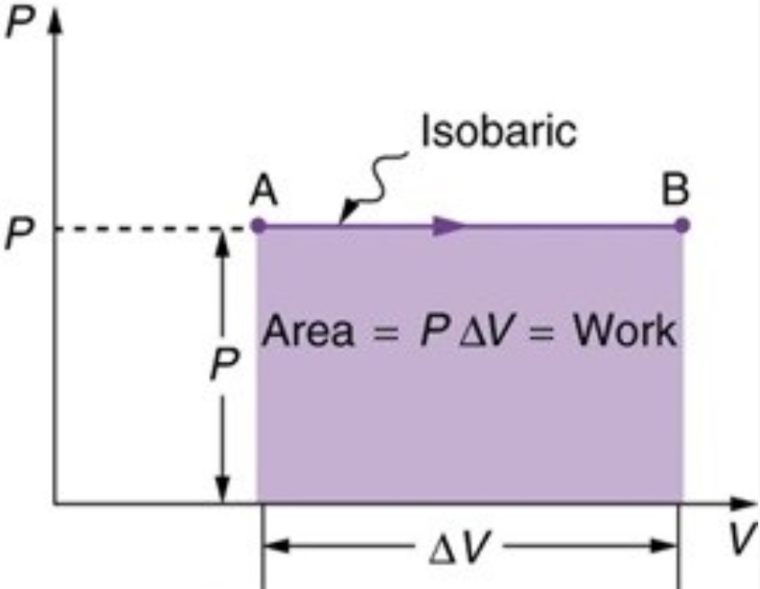
Isobarik merupakan proses termodinamika yang gak mengubah nilai tekanan sistem (ΔP = 0). Nilai usaha bisa dihitung dengan persamaan dibawah ini:
W = P . ΔV
Dari rumus diatas, diketahui apabila volume membesar (terjadi pemuaian) maka usaha bernilai positif, dan kalo volume mengecil (terjadi penyusutan) maka usaha bernilai negatif.
3. Isotermik
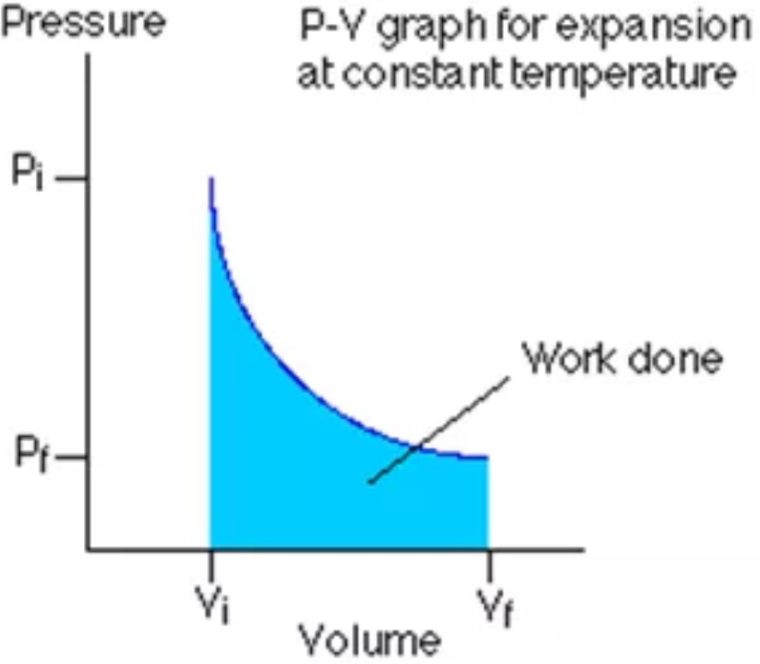
Isotermik merupakan proses termodinamika yang gak mengubah nilai suhu suatu sistem (ΔT = 0). Nilai usaha bisa dihitung dengan persamaan dibawah ini:
W = n.R.T.ln.(Vf/Vi)
Dimana, nilai n adalah jumlah zat yang dinyatakan dengan satuan mol, R adalah konstanta gas, dan T adalah suhu.
Rumus diatas didapatkan dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
4. Adiabatik
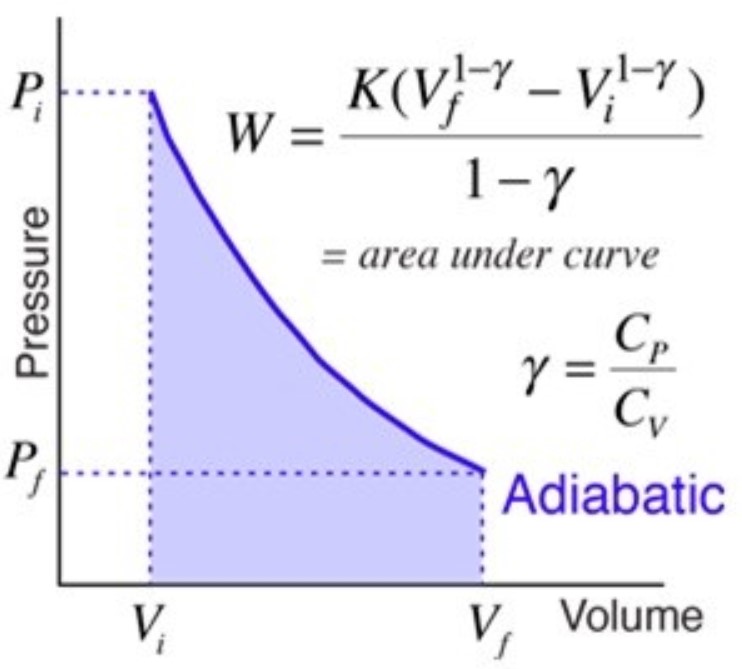
Adiabatik merupakan proses termodinamika yang gak mengubah nilai kalor sistem (Q = 0).
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik ini bisa dinyatakan dengan persamaan berikut ini:
W = (-3/2).n.R.ΔT
Kalo diperhatikan, proses adiabatik dan isotermik mempunyai diagram P-V yang sama. Secara detil, bisa dilihat kalo proses adiabatik mempunyai kemiringan yang lebih curam dibandingkan proses isotermik seperti contoh grafik berikut ini.
Kalo semua proses tersebut digambarkan jadi suatu diagram P-V, bisa didapatkan grafik berikut.
Ingat! Kalo satuan-satuan yang dipakai dalam perhitungan yaitu Satuan Internasional. Contohnya: Satuan buat suhu adalah Kelvin, satuan buat volume adalah m3, dan satuan buat jumlah zat adalah mol.
Jenis – Jenis Siklus
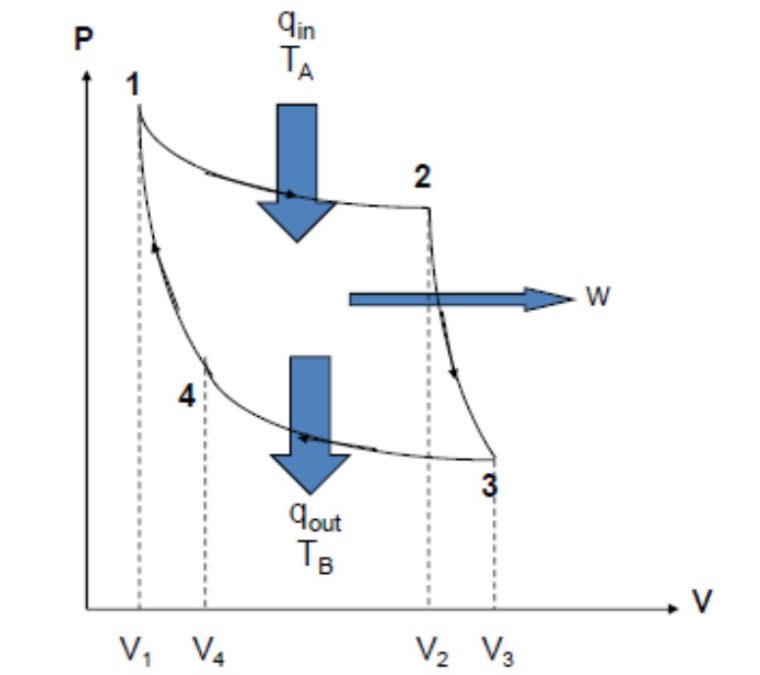
Siklus merupakan serangkaian proses yang dimulai dari suatu keadaan awal dan berakhir pada keadaan yang sama dengan keadaan awalnya.
Supaya bisa melakukan usaha secara terus – menerus, suatu sistem harus bekerja dalam satu siklus. Berikut ada beberapa jenis dari suatu siklus, yaitu:
1. Siklus Carnot
Gambar diatas merupakan gambar siklus mesin pemanas carnot. Nah, ada empat proses dalam siklus Carnot, diantaranya yaitu:
- Pemuaian dengan cara isotermik (a-b)
- Pemuaian dengan cara adiabatik (b-c)
- Pemampatan dengan cara isotermik (c-d)
- Pemampatan dengan cara adiabatik (d-a).
2. Mesin Kalor Carnot
Proses dalam mesin kalor carnot bisa kamu perhatikan gambar siklus carnot yang ada diatas tadi. Siklus bisa menjelaskan sebagai berikut ini:
a. Siklus a-b
Gas menyerap kalor Qt pada temperatur TV suhu sistem sama dengan suhu reservoir panas jadi bisa disebut proses isotermik. Gas memuai dan melakukan suatu usaha pada pengisap.
Makanya, energi dalam tetap maka usaha yang dikerjakan pada sistem sama dengan kalor yang diserap.
b. Siklus b-c
Beban pengisap dikurangi, jadi menyebabkan gas memuai menurut proses adiabatik. Terjadinya pengurangan energi dalam dan suhu sistem menurun sampai sama dengan suhu pada reservoir dingin Tr.
c. Siklus c-d
Gas mengalami penyusutan dengan cara isotermik dengan membuang kalor Qr pada reservoir dingin pada temperatur 7 jadi usaha negatif (usaha dilakukan pada sistem).
d. Siklus d-1
Beban pengisap ditambahkan, jadi gas menyusut menurut proses adiabatik.
Terjadinya penambahan energi dalam dan suhu naik sampai sama dengan suhu pada reservoir panas T. Energi dalam suatu gas kembali seperti pada awal siklus.
Karakteristik mesin kalor carnot dinyatakan dengan efisiensi mesin (η) yaitu perbandingan antara usaha yang dilakukan dengan kalor yang diserap. Secara matematis ditulis sebagai berikut ini:
η = W/Qt x100%
η = (QrQt/Qt) x100%
η = (1 – Qr/Qt) x100%
Efisiensi suatu mesin kalor jenis apapun selalu lebih kecil dari efisiensi mesin ideal atau mesin Carnot.
Berdasarkan hukum I Termodinamika berlaku seperti ini:
Qr / Qt = Tr / Tt
Keterangan:
- η = Efisiensi mesin
- Tr = Temperatur pada reservoir rendah
- Tt = Temperatur pada reservoir tinggi
- Qr = Kalor yang dibuang pada reservoir rendah
- Qt = Kalor yang diserap pada reservoir tinggi.
3. Mesin Pendingin Carnot
Siklus mesin pendingin Carnot merupakan kebalikan siklus mesin kalor Carnot karena siklusnya merupakan reversibel (bisa balik).
Contohnya: Mesin pendingin Carnot yaitu mesin pendingin ruangan dan lemari es.
Usaha pada mesin pendingin Carnot dapat dituliskan sebagai berikut ini :
W = Qt – Qy
Karakteristik pada mesin pendingin dinyatakan dengan koefisien performansi atau koefisien kinerja dengan simbol Kd.
Koefisien kinerja didefinisikan sebagai perbandingan usaha antara kalor yang dipindahkan dengan usaha yang dilakukan sistem.
4. Mesin Pemanas Carnot
Karakteristik mesin pemanas dinyatakan dengan koefisien kerja dengan simbol Kp . Secara matematis bisa dituliskan sebagai berikut ini:
Kp = Qt/W = Qt/(Qt – Qy)
Kp = Tt/(Tt / Tr)
Kp = 1/η
Jenis – Jenis Entropi
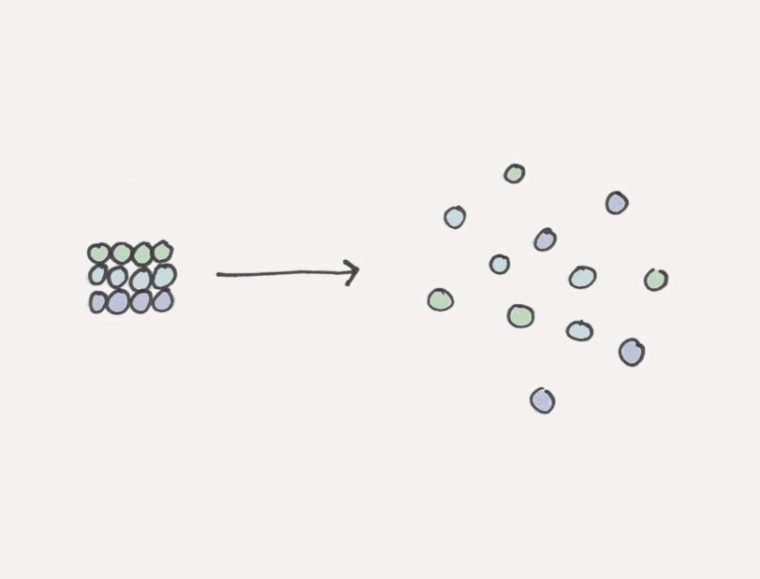
Entropi bisa kamu artikan sebagai ukuran yang ketidakteraturan. Dalam sistem tertutup, peningkatan entropi disertai oleh penurunan jumlah energi yang ada.
Jadi, semakin tinggi entropi tersebut, maka akan semakin tinggi juga ketidakteraturannya.
1. Entropi pada Proses Temperatur Konstan
Kalo suatu sistem pada suhu mutlak (T) mengalami proses reversibel dengan menyerap sejumlah kalor (Q), maka kenaikan entropi ∆S bisa dituliskan sebagai berikut ini:
∆S = S1 – S2 = Q/T
Keterangan:
- ∆S = Perubahan entropi (J/K)
- S1 = Entropi mula – mula (J/K)
- S2 = Entropi akhir (J/K)
2. Entropi pada Proses Temperatur Berubah
∆S = m.c In (T2 / T1)
Keterangan:
- ∆S = Perubahan entropi (J/K)
- S1 = Entropi mula-mula (J/K)
- S2 = Entropi akhir (J/K)
- c = Kalor jenis (J/kg K)
- m = Massa (kg)
- T1 = Suhu mula – mula (K)
- T2 = Suhu akhir (K)
Rumus Hukum Termodinamika

Dari bunyi hukum 1 Termodinamika, maka rumus hukum 1 termodinamika bisa dituliskan seperti yang ada dibawah ini:
Q = ∆U + W ataupun ∆U = Q – W
Keterangan:
- ∆U = Perubahan energi dalam sistem (J)
- Q = Kalor yang diterima ataupun dilepas sistem (J)
- W = Usaha (J)
Contoh Soal Termodinamika

1. Suatu mesin mempunyai suhu reservoir tinggi 400°C dan suhu reservoir rendah 70°C. Hitunglah efisiensi pada mesin tersebut.
Jawaban:
Diketahui:
- Tt = 400°C atau 673 k
- Tr = 70°C atau 343 k
Ditanya: η?
Dijawab:
- η = (1 – Qr/Qt) x100%
- η = (1 – (343/673)) x100%
- η = 330/673 x100% = 49%
Jadi, efisiensi mesin yang dihasilkan adalah sebesar 49%
2. Suatu sistem menyerap kalor sebesar 60 kJ pada suhu 27°C. Berapakah perubahan entropi sistem tersebut?
Jawaban:
Diketahui:
- Q = 60 kJ atau 60.000 J
- T = 27°C atau 300 K
Ditanya: Perubahan entropi sistem (∆S)?
Dijawab:
- ∆S = Q/T
- ∆S = 60.000 J/300 J
- ∆S = 200 J/K
Jadi, besar perubahan entropinya adalah sebesar 200 J/K.
Mudah – mudahan pembahasan diatas bisa membantu dan bermanfaat buat kalian semua 😀

