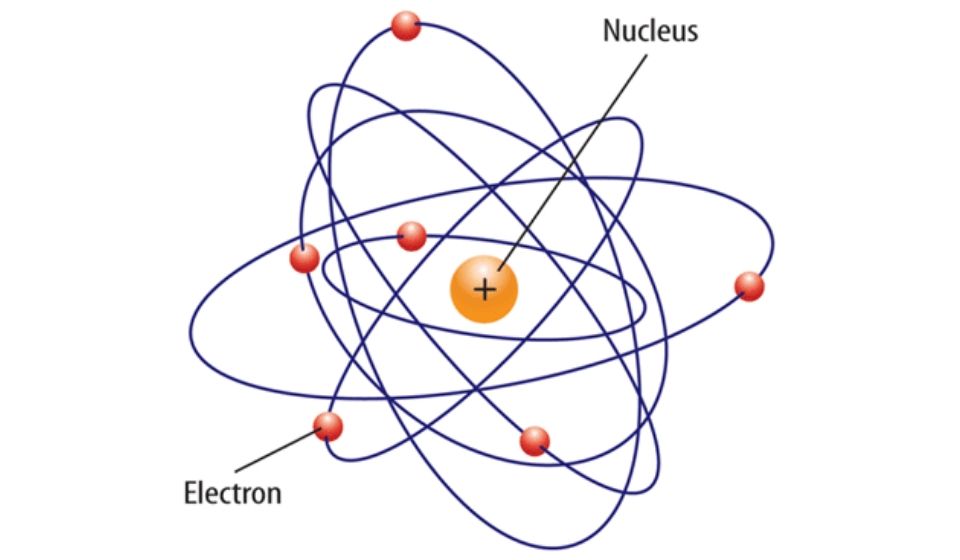
Teori atom merupakan teori ilmiah yang sifat alami materi, yang menyatakan kalo materi tersusun atas satuan terkecil yang disebut atom.
Nah, didalam atom ada beberapa jenis teori atom. Salah satunya adalah teori atom mekanika kuantum.
Sebenarnya, teori atom mekanika kuantum itu apa sih? Penasaran? Langsung aja simak penjelasannya yuk!
Teori Atom Mekanika Kuantum Menurut Para Ahli
Ada beberapa ahli atau ilmuwan yang berpendapat tentang teori mekanika kuantum, berikut penjelasannya:
1. Louis Victor de Broglie

Mengatakan: Gerakan partikel seperti elektron mempunyai sifat – sifat panjang gelombang, jadi berlaku hukum – hukum gelombang, yaitu:
Hukum Gelombang: λ = h/p = h/(m.v)
2. Werner Heinsberg

Mengatakan: Kedudukan dan momentum elektron tidak bisa ditentukan dengan tepat secara bersamaan (dikenal dengan Asas Ketidakpastian).
Jadi, elektron yang mengelilingi inti, jaraknya dari inti cuma bisa ditentukan dengan kemungkinan – kemungkinan aja.
3. Erwin Schrodinger

Mengatakan: Kalo elektron bisa dianggap sebagai gelombang materi yang gerakannya bisa disamakan dengan gerakan gelombang, pernyataan ini disebut mekanika gelombang (mekanika kuantum).
Juga mengatakan: Kedudukan elektron dalam atom gak bisa ditentukan secara pasti, yang bisa ditentukan cuma probabilitasnya (daerah kemungkinan keberadaan) aja. Ruangan yang punya probabilitas terbesar ditemukan elektron disebut Orbital.
Model Atom Mekanika Kuantum
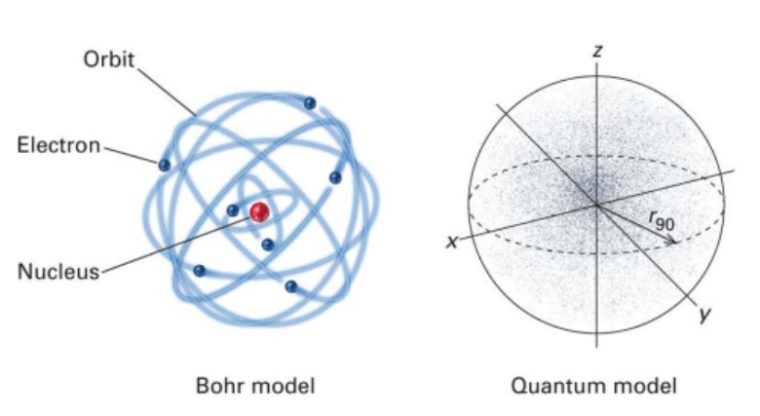
Dalam skala atomik, elektron bisa kamu tinjau sebagai gejala gelombang yang gak mempunyai posisi tertentu di dalam ruang.
Posisi sebuah elektron diwakili oleh kebolehjadian atau peluang terbesar ditemukannya elektron di dalam ruang.
Demi mendapatkan penjelasan yang lengkap dan umum dari struktur atom, prinsip dualisme gelombang – partikel inilah dipakai. Disini gerak elektron digambarkan sebagai sebuah gejala gelombang.
Persamaan dinamika Newton yang sedianya dipakai buat menjelaskan gerak elektron digantikan oleh persamaan Schrodinger yang menyatakan fungsi gelombang buat elektron.
Jadi, Model atom yang didasarkan pada prinsip ini disebut model atom mekanika kuantum.
Persamaan Schrodinger buat elektron di dalam atom bisa memberikan solusi yang diterima, apabila ditetapkan bilangan bulat buat tiga parameter yang beda yang menghasilkan 3 bilangan kuantum.
Ketiga bilangan kuantum ini yaitu bilangan kuantum utama, orbital, dan magnetik. Jadi, gambaran elektron di dalam atom diwakili oleh seperangkat bilangan kuantum ini.
Kelebihan dan Kekurangan Teori Atom Mekanika Kuantum
Teori dan model atom mekanika kuantum yang ditemukan oleh Erwin Schrodinger ini, berhasil menyempurnakan beberapa kelemahan yang ada didalam teori atom Bohr dan membuka pemahaman baru mengenai struktur atom dan pergerakan elektron didalam atom.
Nah, dibawah ini ada beberapa kelebihan dan kekurangan yang ada dalam sebuah atom mekanika kuantum, yaitu:
Kelebihannya:
- Bisa menjelaskan posisi kebolehjadian ditemukannya elektron.
- Bisa menjelaskan posisi elektron saat mengorbit.
- Bisa mengukur perpindahan energi eksitasi dan emisinya.
- Mengidentifikasi proton dan neutron pada inti, sedangkan elektron berada pada orbitnya.
Kekurangannya:
- Persamaan ini cuma bisa diterapkan secara eksak buat partikel dalam kotak dan atom dengan elektron tunggal.
- Sulit diterapkan buat sistem makroskopis dengan kumpulan atom, contohnya hewan.
Teori model atom mekanika kuantum ini didukung dengan rumusan persamaan gelombang yang ditentukan oleh Schrodinge, yaitu persamaan berupa fungsi suatu ruang tiga dimensi.
Gambar Atom Mekanika Kuantum
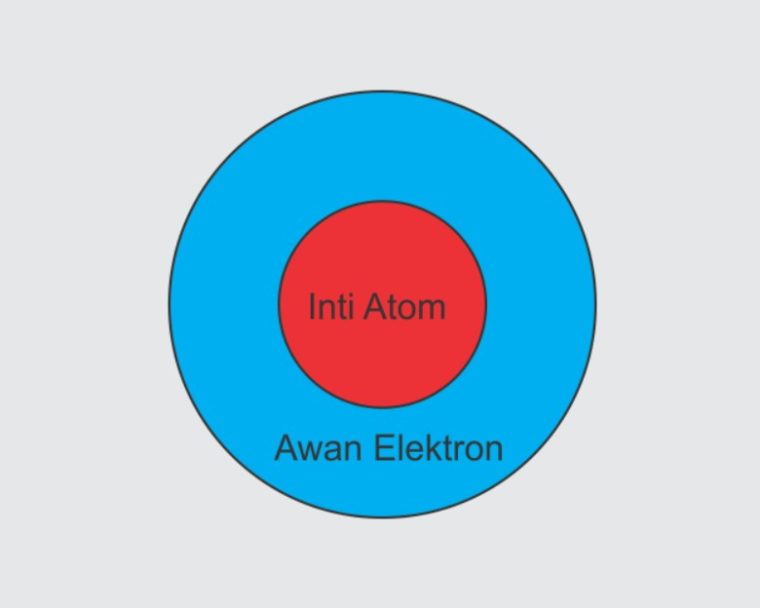
Model Atom Mekanika Kuantum menyatakan kalo elektron dalam atom mempunyai sebuah sifat partikel dan sifat gelombang.
Nah, diatas adalah gambaran dari sebuah model atom mekanika kauntum/modern.
Bilangan Kuantum
Kedudukan elektron dalam sebuah atom, bisa dinyatakan dengan sebuah bilangan kuantum, yaitu:
1. Bilangan Kuantum Utama (n)
Bilangan kuantum ini menyatakan tingkat energi utama elektron dan sebagai ukuran kebolehjadian ditemukannya elektron dari inti atom.
Jadi, bilangan kuantum utama sama dengan tingkat energi elektron atau orbit menurut teori atom Bohr. Bilangan kuantum utama merupakan jarak yang dihitung dari inti atom (sebagai titik nol).
Semakin besar nilai n, maka semakin besar ukuran orbital dan semakin tinggi tingkat energinya.
Buat atom hidrogen, sebagaimana dalam model atom Bohr, elektron pada kulit ke-n memiliki energi sebesar:
En = (-13,6/n2) eV
Juga ada buat atom berelektron banyak (terdiri atas lebih dari satu elektron), energi elektron pada kulit ke-n, yaitu:
En = (-13,6Z2/n2) eV
Dimana Z adalah nomor atom. Nilai-nilai bilangan kuantum utama n adalah bilangan bulat mulai dari 1.
n = 1, 2, 3, 4, ….
Bisa dikatakan kalo bilangan kuantum utama berkaitan dengan kulit elektron di dalam atom. Bilangan kuantum utama membatasi jumlah elektron yang bisa menempati satu lintasan atau kulit berdasarkan persamaan berikut.
Jumlah maksimum elektron pada kulit ke-n adalah 2n2
2. Bilangan Kuantum Azimut (l)

Bilangan kuantum azimut ini, mendeskripsikan bentuk orbital. Nilai l yang diperbolehkan merupakan bilangan bulat dari 0 sampai n − 1.
Bilangan l disebut bilangan kuantum orbital. Jadi, bilangan kuantum orbital l menentukan besar momentum sudut elektron. Nilai bilangan kuantum orbital l yaitu:
l = 0, 1, 2, 3, … (n – 1)
Contohnya, buat n = 2, nilai l yang diperbolehkan adalah l = 0 dan l = 1.
3. Bilangan Kuantum Magnetik (ml)
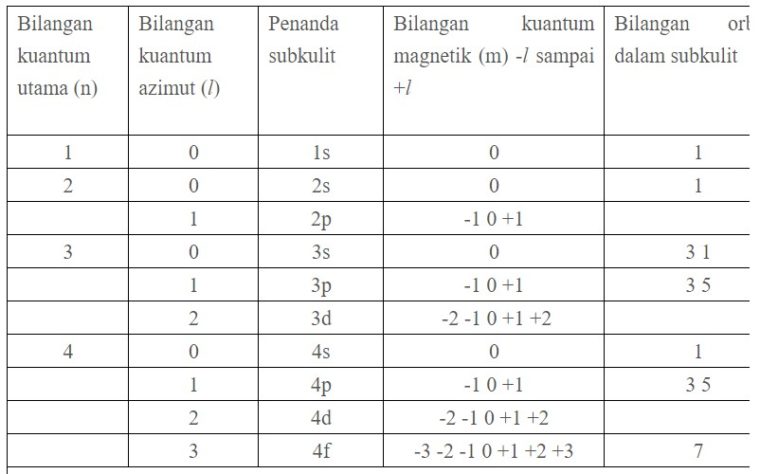
Bilangan kuantum magnetik ini, mendeskripsikan orientasi orbital. Nilai ml yang diperbolehkan merupakan bilangan bulat dari −l sampai +l.
Subkulit-s ( l =0) punya harga m=0, artinya subkulit-s cuma punya 1 buah orbital. Maka, m=0, orbital-s gak punya orientasi dalam ruang jadi bentuk orbital-s dikukuhkan berupa bola yang simetris.
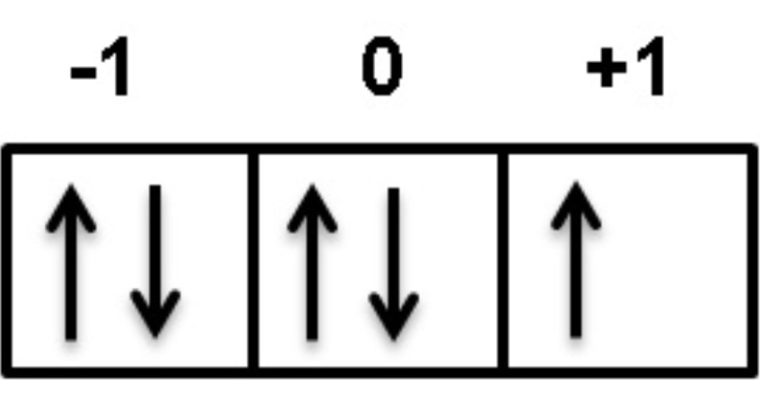
Subkulit-p ( l =1) punya nilai m= -1, 0, +1. Artinya, subkulit-p punya 3 buah orientasi dalam ruang (3 orbital), yaitu orientasi pada sumbu-x dinamakan orbital px, orientasi pada sumbu-y dinamakan orbital py, dan orientasi pada sumbu-z dinamakan orbital pz.
Subkulit-d ( l =2) punya harga m= -2, -1, 0, +1, +2. Artinya, subkulit-d punya 5 buah orientasi dalam ruang (5 orbital), yaitu pada bidang-xy dinamakan orbital dxy pada bidang-xz dinamakan orbital dxz, pada bidang-yz dinamakan orbital d yz, pada sumbu x2 – y2 dinamakan orbital d x2 – y2, dan orientasi pada sumbu z 2 dinamakan orbital dz 2.
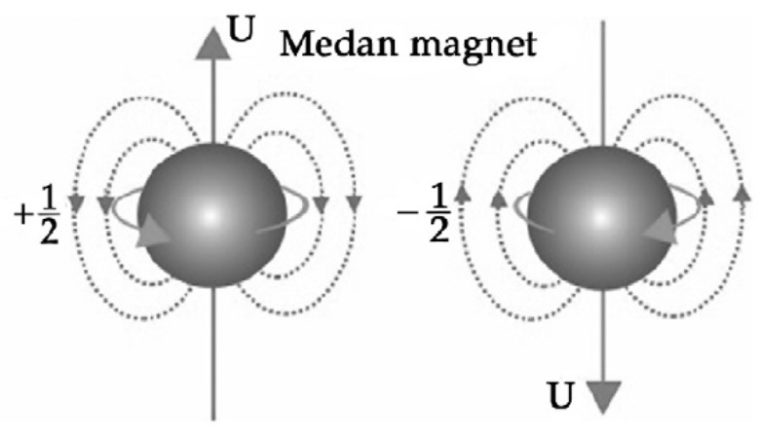
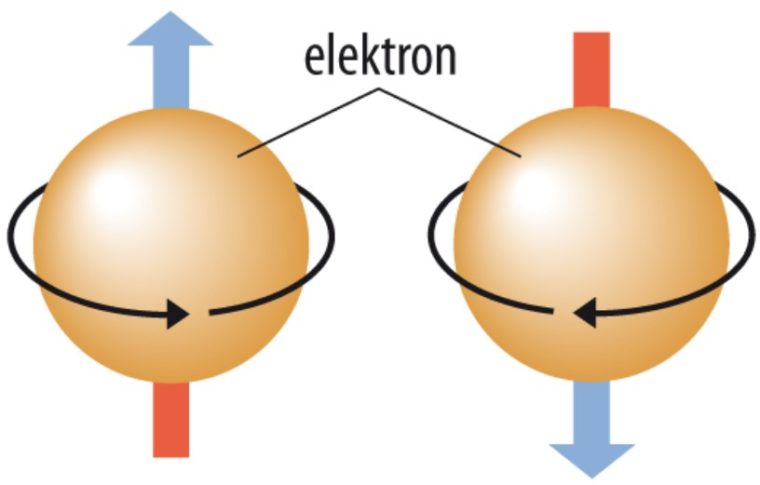
4. Bilangan Kuantum Spin (ms)
Bilangan kuantum spin (ms) ini, mendeskripsikan arah spin elektron dalam orbital. Nilai ms yang diperbolehkan merupakan +½ atau -½.
Kalo ms merupakan bilangan kuantum spin, komponen momentum sudut arah sumbu-z dituliskan sebagai:
Sz= msh , Dimana ms = +- ½
Spin keatas bisa dinyatakan dengan:
ms = + ½
Sedangkan, Spin kebawah bisa dinyatakan dengan:
ms = – ½
Bentuk Orbital Atom
Bentuk orbital bergantung pada bilangan kuantum azimut (l). Orbital dengan bilangan kuantum azimut yang sama akan mempunyai bentuk yang sama.
1. Orbital s
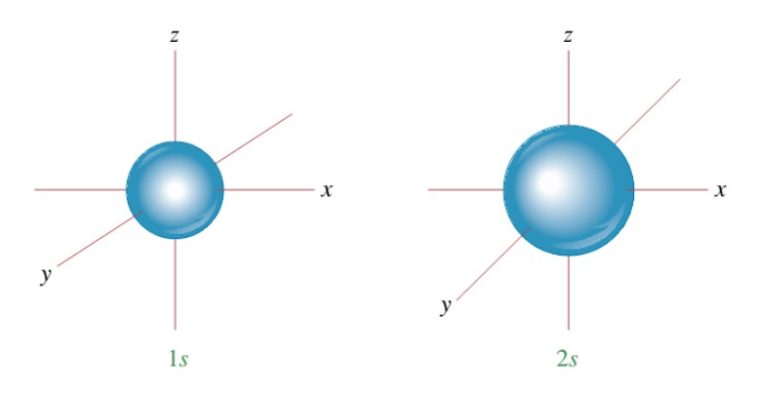
Bentuk orbital subkulit s seperti bola, di manapun elektron beredar maka akan mempunyai jarak yang sama terhadap inti.
2. Orbital p
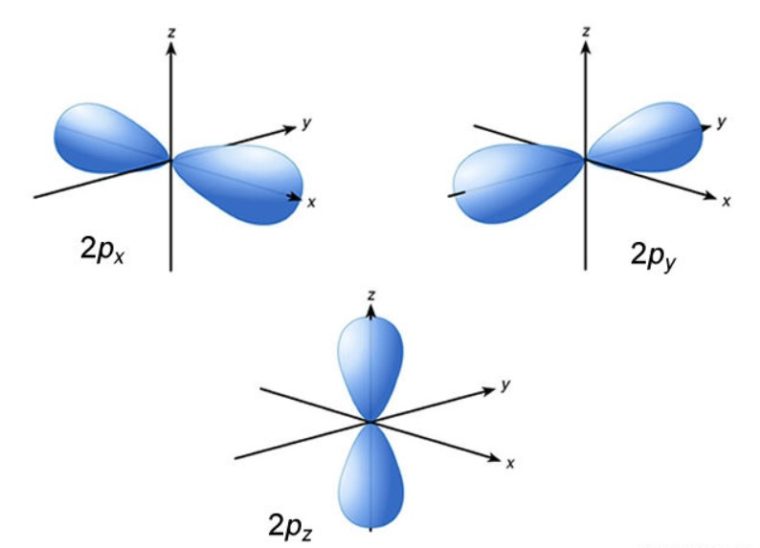
Rapatan elektron terdistribusi pada bagian yang saling berlawanan dengan inti atom inti berada pada simpul dengan kerapatan elektron yaitu nol (0).
Orbital p mempunyai bentuk seperti balon terpilin. Dengan memiliki 3 harga m (-1, 0, +1), maka orbital p ada 3 macam, yaitu px, py, pz.
3. Orbital d
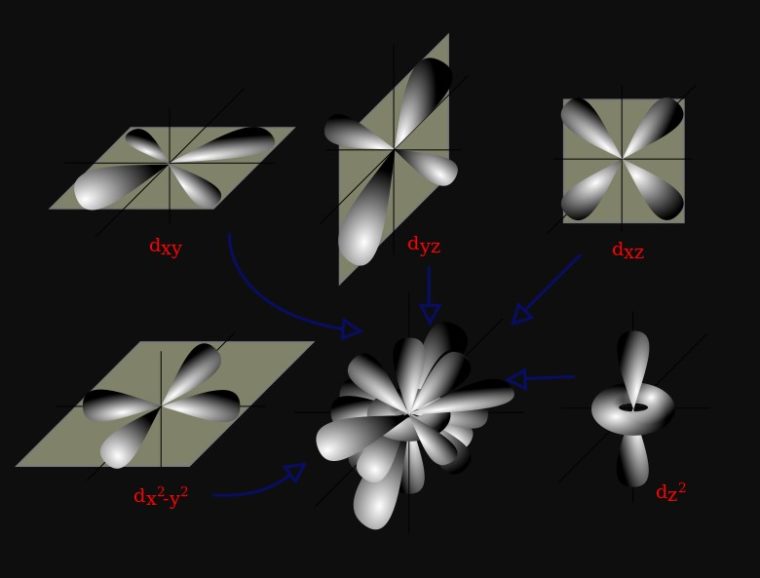
Orbital d yaitu orbital dengan l = 2. Orbital d mempunyai 5 jenis orientasi, sebagaimana terdapat lima nilai ml yang mungkin, yaitu −2, −1, 0, +1, atau +2.
Empat dari lima orbital d, antara lain dxy, dxz dyz, dan dx2−y2, punya 4 cuping seperti bentuk daun semanggi. Orbital d kelima, dz2, punya dua cuping utama pada sumbu z dan satu bagian berbentuk donat pada bagian tengah.
4. Orbital f
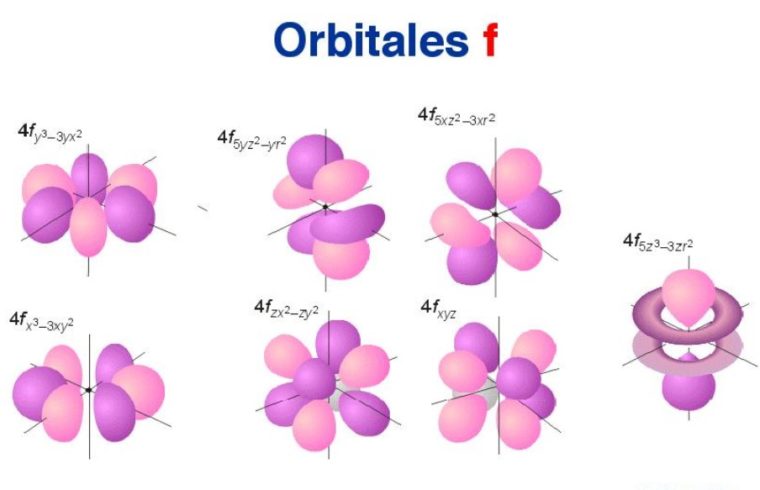
Orbital f merupakan orbital dengan l = 3. Orbital f mempunyai tujuh jenis orientasi, sebagaimana ada tujuh nilai ml yang mungkin (2l + 1 = 7).
Ketujuh orbital f punya bentuk yang kompleks dengan beberapa cuping. Orbital ini cuma bisa dipakai buat unsur – unsur transisi yang letaknya lebih dalam.
Konfigurasi Elektron
Setelah kamu memahami hubungan keberadaan elektron dalam sebuah atom dengan orbital pada teori atom mekanika kuantum.
Selanjutnya ada konfigurasi elektron, yaitu penyusun elektron – elektron dalam orbital – orbital kulit – kulit atomm multi elektron.
Berikut penjelasan dari beberapa jenis konfigurasi elektronnya, yaitu:
1. Asas Aufbau
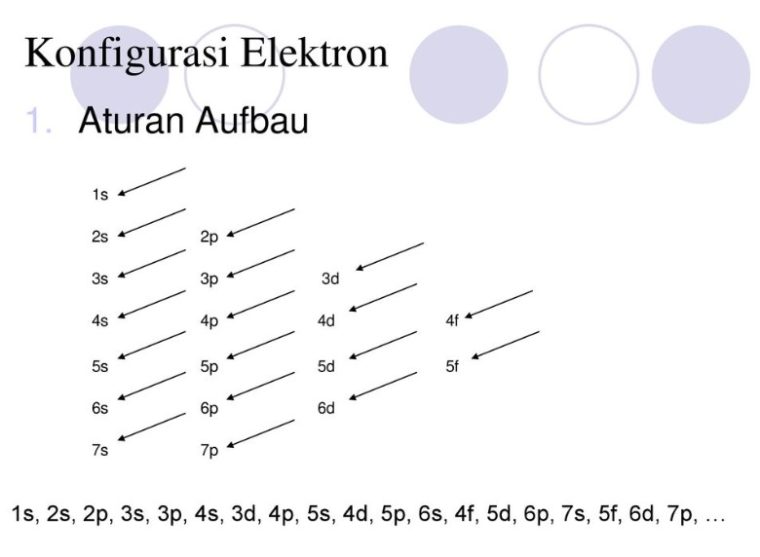
Menyatakan: Elektron menempati orbital – orbital dimulai dari tingkat energi yang terendah, dimulai dari 1s, 2s, 2p, dan seterusnya seperti urutan subkulit yang terlihat pada gambar diatas.
2. Asas Larangan Pauli
Menyatakan: Tidak ada 2 elektron dalam satu atom yang memiliki keempat bilangan kuantum yang sama. Setiap orbital maksimum diisi oleh 2 elektron yang memiliki spin yang berlawanan (ms = +½ dan ms = −½).
3. Kaidah Hund
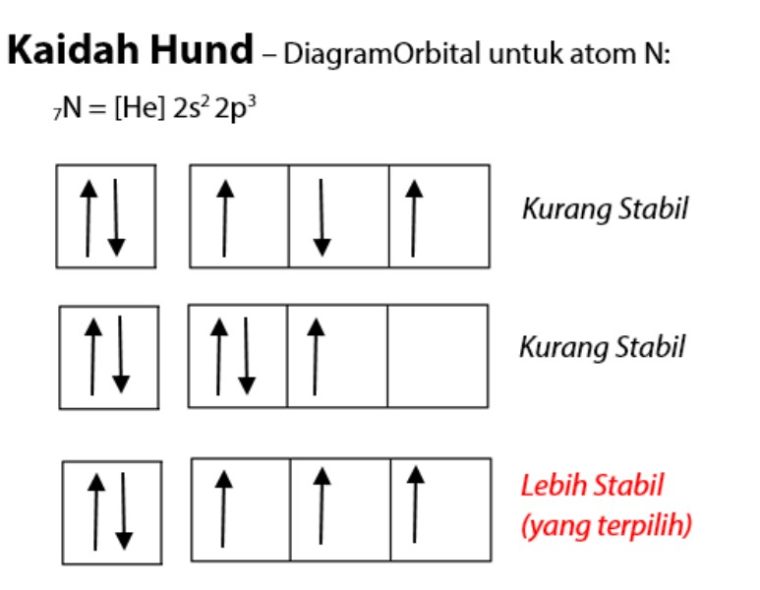
Menyatakan: Kalo ada orbital dengan tingkat energi yang sama, konfigurasi elektron dengan energi terendah adalah dengan jumlah elektron gak berpasangan dengan spin paralel yang paling banyak.
Berdasarkan eksperimen, ada anomali konfigurasi elektron dari aturan – aturan di atas. Subkulit d punya kecenderungan buat terisi setengah penuh atau terisi penuh.
Contohnya, konfigurasi elektron 24Cr: [Ar] 4s1 3d5 lebih stabil dibanding [Ar] 4s2 3d4; dan 29Cu: [Ar] 4s1 3d10 lebih stabil dibanding [Ar] 4s2 3d9.
Konfigurasi elektron buat ion monoatomik (seperti Na+, K+, Ca2+, S2-, Br–) bisa ditentukan dari konfigurasi elektron atom netralnya dulu.
Pada kation (ion bermuatan positif) monoatomik Ax+ yang bermuatan x+, sebanyak x elektron dilepas (dikurangi) dari kulit elektron terluar atom netral A.
Lalu, pada anion (ion bermuatan negatif) monoatomik By− yang bermuatan y−, sebanyak y elektron ditangkap (ditambahkan) pada orbital level energi terendah yang masih belum penuh oleh elektron.
Contoh Soal Bilangan Kuantum

1. Tentukan konfigurasi elektron dan diagram elektron dari atom unsur dan ion monoatomik berikut.
- 27Co
- 32Ge
- 20Mg2+
- 26Fe3+
- 8O2−
Jawaban:
A. 27Co = 1s2 2s2 2p6 3s2 3p6 4s2 3d7 atau [Ar] 4s2 3d7
B. 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 atau [Ar] 4s2 3d10 4p2
C. 20Mg = 1s2 2s2 2p6 3s2 3p6 4s2 atau [Ar] 4s2
20Mg2+ = 1s2 2s2 2p6 3s2 3p6 atau [Ar] (sebanyak 2 elektron dikurangi dari kulit terluar: 4s2−2)
D.26Fe = 1s2 2s2 2p6 3s2 3p6 4s2 3d6 atau [Ar] 4s2 3d6
26Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5 atau [Ar] 3d5 (sebanyak 3 elektron dikurangi dari kulit terluar: 4s2−2 3d6−1)
E. 8O = 1s2 2s2 2p4 atau [He] 2s2 2p4
8O2− = 1s2 2s2 2p6 atau [He] 2s2 2p6 atau [Ne] (sebanyak 2 elektron ditambahkan: 2s2 2p4+2)
Itu tadi beberapa penjelasan yang ada di dalam teori atom mekanika kuantum. Semoga kamu jadi lebih tau ya!