Kamu tahu gak tentang atom karbon yang memiliki kekhasan tersendiri walau jenis dan jumlah senyawa karbon itu ada banyak.
Hal inilah yang bisa membentuk senyawa dengan berbagai unsur dengan struktur yang bervariasi. Nah, buat melanjutkan memahaminya simak penjelasan berikut ini!
Pengertian Karbon
Karbon yaitu unsur Kimia yang mempunyai simbol C dan nomor Atom 6 yang ada pada tabel periodik unsur dan tergolong sebagai unsur nonlogam.
Nah ternyata, karbon itu merupakan unsur terbanyak nomor 4 di alam semesta dan nomor 2 di dalam tubuh manusia, loh!
Senyawa karbon harus punya jumlah minimal karbon sebanyak satu. Tapi, jarang sih senyawa karbon yang cuma punya satu atom karbon.
Jumlah dan bentuk rantai atom karbon itu yang jadi menyebabkan atom karbon memiliki kekhasan yang gak dimiliki atom lain.
Kekhasan Atom Karbon

1. Jari – Jari Atom Karbon Relatif Kecil

Kalo dilihat di tabel periodik unsur, atom karbon ada di periode 2. Artinya, atom karbon cuma punya 2 kulit terluar.
Maka, jari – jari atomnya juga pasti kecil. Besar kecilnya jari – jari atom tuh, berpengaruh pada kuat tidaknya ikatan yang terbentuk.
Mengingat, jari – jari atom karbon ini relatif kecil, ikatan kovalen yang terbentuk akan relatif kuat.
Secara umum, ada 2 bentuk rantai karbon, yaitu:
- Rantai terbuka, berbentuk rantai lurus gak bercabang ataupun bercabang.

- Rantai tertutup, berbentuk rantai melingkar (siklik) seperti cincin.

Berdasarkan jumlah atom C yang diikatnya, atom C dengan 4 ikatan kovalen tunggal dibedakan atas:
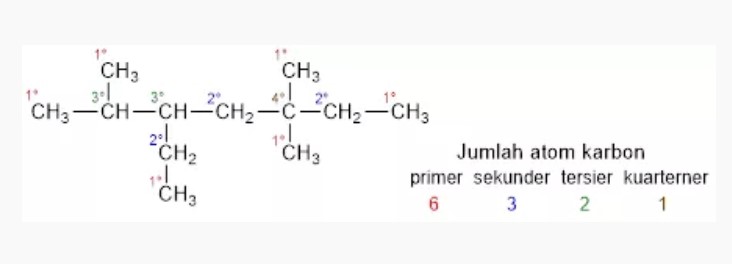
- Atom C primer (1°), kalo terikat langsung dengan 1 atom C lainnya
- Atom C sekunder (2°), kalo terikat langsung dengan 2 atom C lainnya
- Atom C tersier (3°), kalo terikat langsung dengan 3 atom C lainnya
- Atom C kuarterner (4°), kalo terikat langsung dengan 4 atom C lainnya
2. Atom Karbon Memiliki 4 Elektron Valensi
Atom karbon ada 4 elektron valensi atau 4 elektron di kulit terluar menurut konfigurasi Elektronnya.
Nah, elektron valensi ini yang berperan penting buat membentuk ikatan kimia. Setiap atom bisa membentuk kestabilan, termasuk juga atom karbon.
Buat mencapai kestabilan, atom ini butuh 4 elektron lain dengan cara membentuk ikatan kovalen.
Nag, cuma atom karbonlah yang mampu membentuk ikatan kovalen 4 buah buat bisa mencapai keadaan oktet.
Berikut beberapa contoh senyawa karbon di mana atom C berikatan kovalen dengan atom – atom unsur lain.

3. Atom Karbon bisa Membentuk Rantai karbon
Dengan adanya 4 elektron valensi ini, atom karbon bisa membentuk ikatan kovalen dengan rantai karbon yang sangat panjang.
Baik ikatan kovalen tunggal, rangkap 2, bahkan rangkap 3. Bahkan gak cuma itu, karon juga bisa membentuk rantai siklik atau melingkar.
Jenis Atom Menurut Ikatan Antar Atom
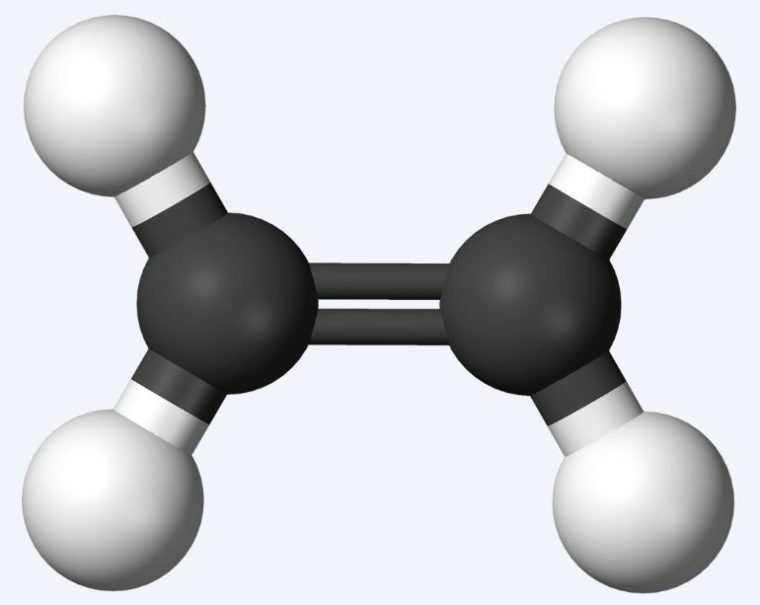
1. Ikatan Jenuh ( Ikatan Tunggal )
Terjadinya ikatan jenuh kalo, masing – masing atom karbon memberikan sebuah electron. Maka, akan membentuk satu pasang electron milik bersama. Lebih jelasnya, simak gambar dibawah ini.

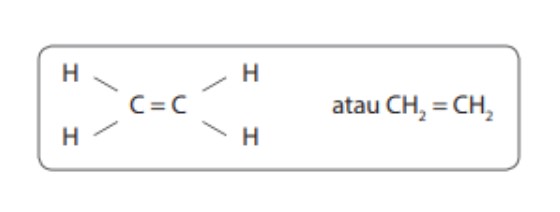
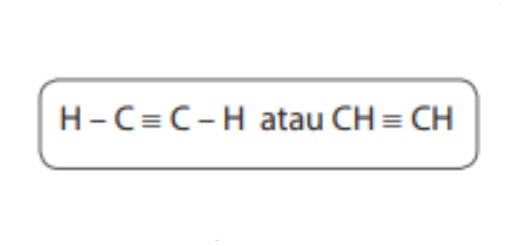
2. Ikatan Tak Jenuh ( Ikatan Rangkap )
Ikatan jenuh yaitu jenis ikatan di mana dua buah atom karbon memberikan lebih dari satu elektron.
Akibatnya, jumlah pasangan elektron yang dimiliki bersama lebih dari satu pasang. Contoh, ikatannya seperti gambar dibawah ini.
Ikatan rangkap dua
Ikatan rangkat tiga
Jenis Karbon Berdasarkan Bentuk Rantai Atom Karbon

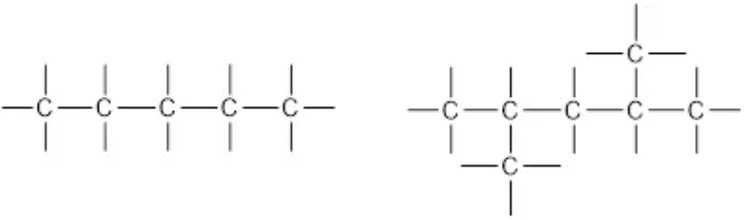
1. Rantai Karbon Alifatik
Rantai karbon alifatik yaitu contoh rantai atom terbuka yang bisa berupa rantai lurus maupun bercabang.
Contoh senyawa yang memiliki rantai karbon alifatik adalah n-butana dengan rumus molekul C4H10. Untuk rumus molekul yang sama, contoh rantai alifatik bercabang bisa Quipperian lihat pada 2-metilpropana.
2. Rantai Karbon Siklik
Kalo rantai karbon alifatik terbuka, beda dengan rantai karbon siklik yang mempunyai sifat tertutup.
Rantai ini mempunyai ikatan rangkat didalamnya dan dibedakan menjadi 2 berdasarkan komponen penyusunnya.
- Karbosiklik yaitu senyawa karbon siklik yang memiliki satu atom C di rantai lingkarnya.
- Heterosiklik yaitu senyawa yang memiliki atom lain selain C di dalam rantai sikliknya.
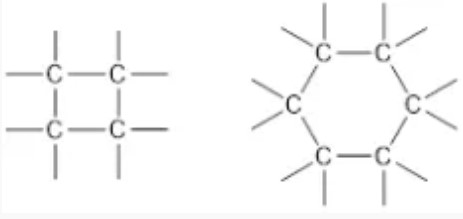
3. Rantai Karbon Aromatis
Rantai karbon aromatis ini salah satu bentuk kekhasan atom karbon yang gak akan bisa ditemukan di atom – atom lainnya.
Rantai karbon aromatis ini ada 6 atom karbon yang membentuk rantai siklik dengan ikatan rangkap yang berselang – seling.
Dengan adanya ikatan rangkap yang bersaling – seling ini, akan memicu terbentuknya awan – awan elektron yang ada di sekeliling ikatan rangkap.
Senyawa yang mempunyai rantai karbon aromatis disebut sebagai Benzena. Contoh benzena yaitu Natrium Benzoat yang sering dipakai sebagai bahan pengawet makanan.
Mengenal Senyawa Karbon Organik

Dalam sampel senyawa organik, ada unsur karbon dan hidrogen yang bisa ditunjukan dengan uji coba pembakaran (oksidasi).
Pembakaran gak sempurna dari sampel organik bisa menghasilkan zat sisa berupa arang (karbon).
Pembakaran sempurna dari sampel organik akan mengubah karbon (C) jadi gas karbon dioksida (CO2) dan hidrogen (H) jadi air (H2O).
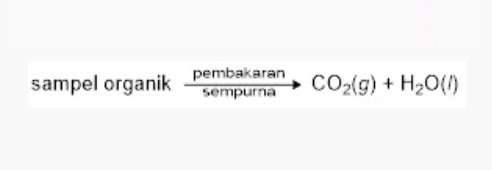
Gas CO2 bisa dikenali dengan mengalirkannya ke dalam air kapur (larutan Ca(OH)2) atau air barit (larutan Ba(OH)2).
Kalo larutan jadi keruh, maka gas tersebut yaitu CO2 dan H2O bisa dikenali pakai kertas kobalt.
H2O akan mengubah warna kertas kobalt dari biru jadi merah jambu.

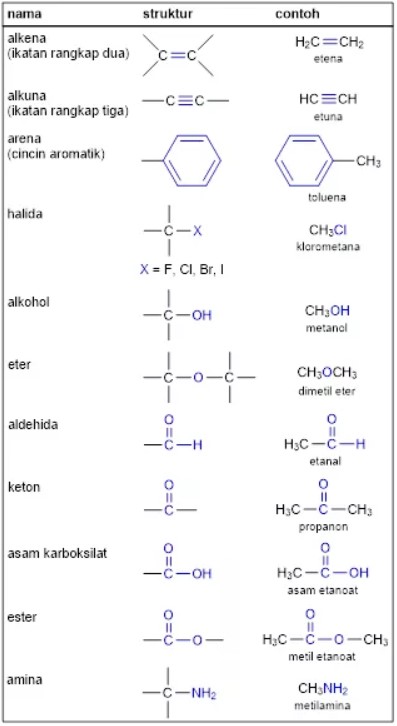
Gugus Fungsi Senyawa Organik

Senyawa organik bisa diklasifikasikan ke dalam kelompok senyawa berdasarkan gugus fungsinya.
Gugus fungsi yaitu kelompok atom dalam suatu molekul yang jadi molekul senyawa tersebut punya sifat Kimia yang khas.
Contohnya, asam propanoat (CH3CH2COOH) punya gugus fungsi – COOH (asam karboksilat) yang menjadikannya bersifat asam.
Dibawah ini, beberapa contoh gugus fungsi Organik dengan senyawanya.
Senyawa Karbon Organik dan Anorganik

1. Abilitas Terhadap Pemanasan
Senyawa organik ini sangat tidak stabil terhadap adanya pemanasan. Seharusnya, pada suhu diatas 600°C, senyawa organik umumnya udah terurai.
Kenapa? Karena, senyawa organik ini punya ikatan kovalen yang lebih lemah. dibanding dengan ionik yang ada pada senyawa anorganik.
2. Daya Hantar Listrik
Senyawa organik pada umumnyagak menghantarkan listrik ( non-elektrolit ).
Sedangkan, senyawa anorganik yaitu senyawa ionik yang bisa menghantarkan listrik ( elektrolit ).
3. Titik Leleh dan Titik Didih
Senyawa organik ini pasti mempunyai titik leleh dan titik didih yang relatif rendah.
Sedangkan, senyawa anorganik terutama pada senyawa ionik punya titik leleh dan titik didih yang tinggi, umumnya berwujud padatan kristal suhu.
4. Kelarutan
Senyawa organik lebih mudah larut ke pelarut yang relatif nonpolar (seperti eter dan kloroform) dibanding dengan pelarut polar (seperti air dan asam asetat).
Sedangkan, senyawa anorganik ini lebih mudah larut dalam pelarut polar.
5. Kereaktifan
Reaksi senyawa organik berlangsung lebih lambat dari reaksi anorganik, kecuali reaksi pembakaran.
Banyak senyawa organik palah lebih mudah terbakar, tapi kurang reaktif ke pereaktif lainnya.
Woohoo, sudah selesai bahas kekhasan atom karbon nih. Semoga paham ya!


Mau kasih saran min
Kalau bisa ada gambar nya, misal alkena kan ikatan rangkap 2 itu gimana ikatannya..
Atau siklis gimana bentuk ikatannya bahkan aromatis juga
Soalnya template nya sudah keren
Terima kasih