Kamu udah pernah memperlajari tentang jari-jari Atom belum sih? Pasti udah pernah kan?
Nah buat kamu, yang belum mengetahui dan ingin belajar jari-jari Atom itu apa? Yuk, langsung aja simak pembahasan berikut ini.
Pengertian Jari-jari Atom

jari-jari atom yaitu jarak dari inti atom ke orbital elektron yang paling luar yang stabil pada suatu atom dalam keadaan setimbang.
Biasanya, jarak itu diukur kedalam satuan pikometer atau angstrom. Karena, elektron selalu bergerak, maka buat mengukur jarak dari inti atomnya begitu sulit.
Jenis Jari-jari Atom

Ada beberapa jenis jari-jari Atom yang dipakai buat menyatakan jarak dari inti atom ke lintasan stabil yang paling luar dari elektronnya, di antaranya yaitu.
1. jari-jari Kovalen
jari-jari Atom yang diukur memakai jari-jari kovalen buat elemen – elemen yang mempunyai jenis ikatan kovalen. Elemen ini yaitu elemen non – logam.
Secara teknis, jarak yang diukur yaitu setengah dari jarak internuklir antara dua atom yang berdekatan dalam kisi kristal.
jari-jari kovalen buat elemen yang gak bisa berikatan bisa dilakukan dengan kombinasi jari-jari dari elemen yang bisa berikatan pada molekul buat atom yang beda.
2. jari-jari Van Der Waals
jari-jari Atom yang diukur pakai jari-jari Van Der Waals buat elemen yang atom – atomnya gak bisa saling berikatan.
Contohnya, dari kelompok ini yaitu gas mulia, dikatakan kalo atom – atom dari elemen ini gak termampatkan atau terpadatkan.
3. jari-jari Logam
jari-jari Atom yang diukur pakai jari-jari Logam buat elemen – elemen yang termasuk pada elemen – elemen logam.
jari-jari Logam yaitu setengah jarak dari jarak internuklir terdekat dari atom – atom dalam kristal logam.
Kecenderungan jari-jari Atom dalam Tabel Periodik

Pola kecenderungan jari-jari atom tergantung dari jenis jari-jari atom mana yang ingin kamu ukur. Tapi, pada prinsipnya pola seluruhnya sama.
1. Kecenderungan pada suatu Golongan
Kamu bisa segera memperkirakan, kalo jari-jari Atom pada golongan yang sama akan semakin besar kalo letak atom itu pada tabel periodik semakin di bawah.
Alasannya, karena cukup kuat dan kulit yang ada pada elektron semakin bertambah.
2. Kecenderungan pada satu Periode
Dari litium ke flor, elektron seluruhnya ada di level 2, dihalangi sama elektron pada 1s2.
Peningkatan jumlah proton pada nukleus seiring dengan menyusurnya periode akan menarik elektron – elektron lebih kuat.
Kecenderungan pada energi ionisasi yang naik turun gak kamu temui pada radius atom. Pada periode dari Natrium ke Klor, kamu juga akan menemukan kecenderungan yang sama.
Besar atom dikontrol oleh elektron – elektron di tingkat ke 3 yang tertarik semakin dekat ke nukleus seiring dengan meningkatnya jumlah proton.
3. Kecenderungan Menyusur satu Periode
Kamu abaikan aja jari-jari gas mulia pada setiap periode. Karena, neon dan argon gak membentuk ikatan, kamu cuma bisa mengukur jari-jari van der Waals yang ikatannya sangat lemah.
Seluruh atom -atom lainnya jari-jari atom diukur berdasarkan jarak yang lebih kecil dikarenakan oleh kuatnya ikatan yang terbentuk.
Faktor yang Mempengaruhi Panjang jari-jari Atom

Panjang atau pendeknya jari-jari Atom bisa ditentukan oleh 2 faktor, antara lain:
1. Jumlah Kulit Atom
Semakin banyak jumlah kulit yang ada di suatu atom, maka jari-jari atomnya juga semakin panjang.
jari-jari Atom Natrium lebih panjang daripada jari-jari atom Litium. Karena, jumlah kulit yang dimiliki atom Natrium lebih banyak dibandingkan dengan atom Litium.
2. Muatan Inti Atom
Kalo jumlah kulit dari 2 atom sama banyak, maka yang berpengaruh terhadap panjangnya jari-jari atom yaitu muatan inti atom.
Apabila, inti atomnya semakin banyak, berarti semakin besar juga muatan inti dan gaya tarik inti atom terhadap elektron lebih kuat jadi elektron lebih mendekat ke inti atom.
Tabel Nilai jari-jari Atom
NOTE: Semua pengukuran dituliskan dalam satuan pikometer (pm).
- Radius suatu atom bukan suatu karakteristik yang unik dan bergantung dari definisi. Data yang diambil dari sumber yang beda dengan asumsi (pemodelan atau pengukuran) yang beda gak bisa saling dibandingkan.
- † sampai dengan ketelitian kira – kira 5 pm.
- – data gak tersedia.
Grafik jari-jari Atom
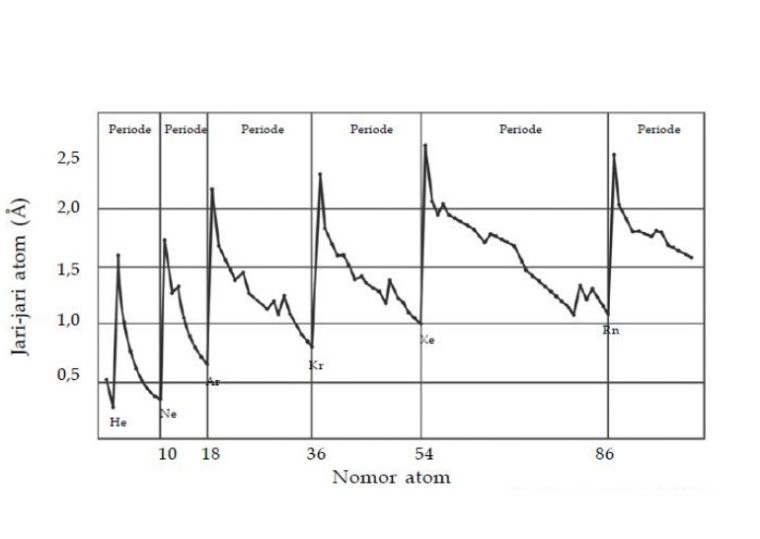
Dari grafik jari-jari Atom diatas, bisa kamu simpulkan kalo:
Buat unsur – unsur dengan golongan yang sama, maka jari-jari atom akan meningkat seiring dengan bertambahnya nomor atom.
Dengan kata lain, dari atas sampai ke bawah jari-jari atom akan bertambah. Maka, bisa disebabkan karena bertambahnya orbit atau lintasan elektron jadi volume atom mengembang dan jari-jari atom semakin besar.
Cara Mengukur jari-jari Atom

Gak seperti bola, sebuah atom gak mempunyai jari-jari yang tetap. jari-jari atom cuma bisa didapat dengan mengukur setengah dari jarak antara dua buah atom yang berapitan.
Pada atom yang sama, kamu bisa dapat jari-jari yang beda tergantung dari atom yang berapitan dengannya.
Kedua atom ini, saling menarik satu sama lain. Jadi, jari-jarinya lebih pendek dibanding kalo mereka cuma bersentuhan aja.
Hal ini kamu dapat pada atom – atom logam, di mana mereka membentuk struktur logam atau atom – atomnya secara kovalen berikatan satu sama lain.
Tipe dari jari-jari atom seperti ini, disebut jari-jari (radius) logam atau jari-jari kovalen, tergantung dari ikatannya.
Nah, buat tipe dari jari-jari atom yang lain, dinamakan jari-jari (radius) van der Waals, di mana terjadi daya tarik yang lemah di antara kedua atom tersebut.
Gimana tuh pembahasannya, jadi lebih tahu kan? Kalo ada pertanyaan atau yang lainnya, bisa langsung tulis di kolom komentar 😀

